Erforschung von Neurofibromatose dank revolutionärer cryoEM-Methode
Tiroler Forscher entschlüsselten wichtiges Neurofibromin-Gen
Dem Strukturbiologen Bernhard Rupp von der Medizinischen Universität Innsbruck ist es mit seinem früheren Mitarbeiter Andreas Naschberger und weiteren ForscherInnen von der Stockholm University gelungen, erstmals die Molekularstruktur von Neurofibromin in hoher Auflösung zu entschlüsseln. Die Ergebnisse bringen die Erforschung der Erbkrankheit Neurofibromatose einen großen Schritt voran und wurden nun im renommierten Fachjournal Nature veröffentlicht.
Bilder frei zum Download:
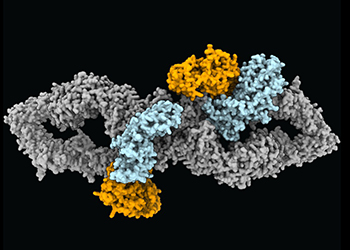
Bild 1: Tiroler und schwedischen ForscherInnen ist es dank der revolutionären cryoEM-Methode gelungen, die Struktur des NF1-Gens zu entschlüsseln (c) GenEpi Innsbruck
Bild 2: Marta Carroni und Andreas Naschberger vor der cryoEM Anlage im SciLifeLab der University of STockholm (c) Mathieu Coinçon
Bild 3: Bernhard Rupp (c) privat
Innsbruck, am 28.Oktober 2021: Veränderungen in dem wichtigen Tumorsuppressor*-Protein Neurofibromin durch Mutationen im NF1 Gen sind ursächlich für die autosomal dominant vererbbare monogenetische Erkrankung Neurofibromatose Typ 1. „Patientinnen und Patienten, die an Neurofibromatose erkrankt sind, leiden an verschiedensten Symptomen, oft hervorgerufen von gutartigen oder bösartigen Tumoren der Haut und des Nervensystems, die schon im Kleinkindesalter auftreten können“, sagt Strukturbiologe Bernhard Rupp, der am Institut für Genetische Epidemiologie (Direktor: Florian Kronenberg) an der Medizinischen Universität Innsbruck forscht. „Mit einer Geburtenhäufigkeit von 1:3000 gehört Neurofibromatose zu einer der häufigsten Erbkrankheiten, und das Verständnis der molekularen Mechanismen dieser Erkrankung ist Voraussetzung für die Entwicklung von therapeutischen Ansätzen und Wirksoffen“, erklärt der Wissenschafter. Neurofibromin ist in fünf bis zehn Prozent aller spontan auftretenden Tumoren mutiert und als direkter Regulator des Proto-Onkogens* RAS auch in den Fokus der Krebsforschung gerückt.
Für die Strukturaufklärung haben die WissenschafterInnen eine Technik benutzt, die in den vergangenen Jahren eine Revolution in der Strukturbiologie ausgelöst hat. Mit der kryo-Elektronen Mikroskopie (cryoEM), für deren Entwicklung 2017 der Nobelpreis für Chemie verliehen wurde, ist es möglich, Projektionen von Abbildungen einzelner makromolekularer Strukturen, eingebettet in einer dünnen amorphen Eisschicht, aufzunehmen. Aus vielen dieser zweidimensionalen Projektionen kann die gesamte dreidimensionale Struktur rechnerisch rekonstruiert werden. Dabei werden mittlerweile Auflösungen erzielt, die es erlauben, die räumliche Anordnung der Proteinmoleküle (Konformation), oft bereits in atomarem Detail, zu bestimmen.
Therapeutische Angriffsfläche
Es kommt nicht jeden Tag vor, dass eine Studie von Tiroler ForscherInnen in dem prestigereichen wissenschaftlichen Fachjournal Nature veröffentlicht wird. Die aktuelle Publikation zeigt eindrucksvoll, dass Neurofibromin zwei biologische Zustände einnehmen kann (Download Animation). In einer dieser Anordnungen ist Neurofibromin inaktiv, da seine katalytische Domäne* (GRD) durch seine eigene zentrale Kerndomäne sterisch inhibiert ist. Das bedeutet, dass der Zugang der GRD an das Onkoprotein RAS* nicht möglich ist, was zu unkontrolliertem Zellwachstum und Krebs führen kann.
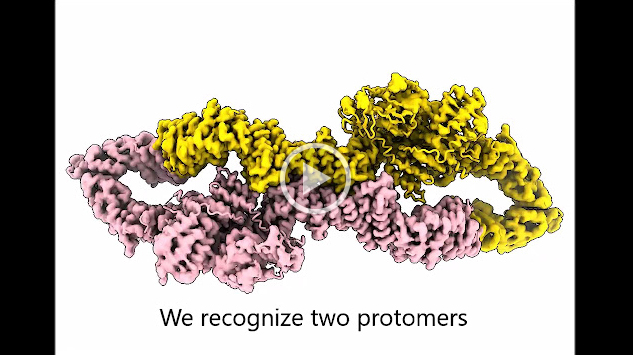
(Animation ansehen, Link öffnet in neuem Fenster)
In der aktiven Form von Neurofibromin kann die katalytische Domäne durch eine massive Konformationsänderung RAS binden, und RAS kann daher reguliert werden. „Das Ergebnis zeigt, dass nicht nur RAS selbst wie ein molekularer Schalter an- und abgeschaltet werden kann, sondern, dass auch Neurofibromin einen inaktiven und aktiven Zustand besitzt", erklärt Andreas Naschberger, der das Projekt als Postdoktorand in Innsbruck zusammen mit Rupp konzipiert und das Protein hergestellt hat.
Die Struktur erklärt zudem, warum eine Vielzahl krankmachender Mutationen auch außerhalb der katalytischen Domäne auftritt, da für die beschriebene weitreichende Konformationsänderung Neurofibromin flexibel sein muss. Diese notwendige Flexibilität kann durch Mutationen an vielen Stellen des gesamten Proteins effektiv eingeschränkt werden, sodass Neurofibromin nicht mehr in die aktive, funktionelle Form übergehen kann. Aus diesem Grund kann die Krankheit auftreten, auch wenn die Mutationen nicht in der katalytischen Domäne liegen.
Revolutionäre Technik
*Tumorsuppressor: Ein Protein, das andere, krebsverursachende Proteine reguliert.
*Proto-Onkogen RAS: Ein Protein, das bei fehlerhafter Regulierung Krebswucherung verursacht.
*Katalytische Domaine: Ein wichtiger Teilbereich des Tumorsuppressor-Proteins Neurofibromin, der an das RAS Onkogen bindet (GRD, GTPase-activating Protein-related Domain)
Steckbrief:
Bernhard Rupp ist unabhängiger Leiter seiner FWF-Projekte am Institut für Genetische Epidemiologie an der Medizinischen Universität Innsbruck. Seine fast 170 wissenschaftlichen Arbeiten reichen thematisch von viralen und bakteriellen Proteasen und Toxinen, Plasmaproteinen, Strukturgenomik und Wirkstoff-Design, bis zu Methodenentwicklung und Validierung von Strukturmodellen. Rupp hat sein Doktorat in Physikalischer Chemie sowie die Habilitation in Molekularer Strukturbiologie an der Universität Wien erlangt, arbeitete danach in Israel, Deutschland, der Schweiz und seit mehr als 30 Jahren auch in den USA.
Forschungsarbeit:
The structure of neurofibromin isoform 2 reveals different functional states. Nature. https://www.nature.com/articles/s41586-021-04024-x
Weiterführende Links:
Institut für Genetische Epidemiologie an der Medizinischen Universität Innsbruck
PR & Medien
Kontakt für Rückfragen:
Bernhard Rupp
Mobiltelefon: +43 676 571 0536
bernhard.rupp@i-med.ac.at
Medienkontakt:
Medizinische Universität Innsbruck
Public Relations und Medien
Theresa Mair
Innrain 52, 6020 Innsbruck, Austria
Telefon: +43 512 9003 71833
public-relations@i-med.ac.at
www.i-med.ac.at
Kontakt für Rückfragen:
Bernhard Rupp
Mobiltelefon: +43 676 571 0536
bernhard.rupp@i-med.ac.at
Medienkontakt:
Medizinische Universität Innsbruck
Public Relations und Medien
Theresa Mair
Innrain 52, 6020 Innsbruck, Austria
Telefon: +43 512 9003 71833
public-relations@i-med.ac.at
www.i-med.ac.at