Download english version
Tiroler Gipfelsieg: SCIENCE berichtet über Innsbrucker Forschungsarbeit
Ein Team des Innsbrucker Biozentrums erleuchtet molekulare Struktur eines krebsrelevanten Proteinkomplexes
Mit der detaillierten atomaren Aufklärung der Kristallstrukturen des sogenannten LAMTOR Komplexes und seiner Implikationen für die zelluläre Signalübertragung sorgt ein Team des Innsbrucker Biozentrums um die Wissenschafter Lukas A. Huber (Zellbiologie) und Klaus Scheffzek (Strukturbiologie) für Aufsehen in der Wissenschaftsgemeinde. Der Proteinkomplex LAMTOR steuert eine Vielzahl essentieller Vorgänge in der Zelle und lässt sich als Schaltweiche für in der Entstehung von Krebs und Stoffwechselkrankheiten relevante Signalwege verstehen. SCIENCE, eines der weltweit angesehensten Wissenschaftsmagazine, berichtet darüber.
Innsbruck, 22.9.2017: Die Signalweiterleitung in Zellen spielt im Kontext der Tumorentstehung, wie auch im Verlauf der Immunantwort und damit in der Entstehung von Stoffwechselerkrankungen wie Diabetes und Metabolisches Syndrom eine essentielle Rolle. LAMTOR, ein bereits vor 15 Jahren u.a. durch die Arbeitsgruppe des Tiroler Zellbiologen Lukas A. Huber identifizierter Verband aus sieben derzeit bekannten Gerüst- und Regulatorproteinen (p18, p14, MP1, HBXIP, p11 auch LAMTOR1-5 genannt, RagA und RagC ) koordiniert Zellteilung, Zellwachstum, Zelltod und Zellwanderung, indem er die unter den Abkürzungen MAPK und mTORC bekannten Signalwege rekrutiert und steuert. In einer vom Fonds für Wissenschaft und Forschung (FWF) geförderten Kooperation gelang den Forschungsgruppen von Huber, Scheffzek und weiteren KollegInnen des Biozentrums der Medizin Uni Innsbruck nun die Aufklärung der dreidimensionalen Struktur des LAMTOR Komplexes und seiner Bedeutung für die Signalübertragung, womit eine Tür zur Entwicklung neuer Therapieansätze geöffnet werden könnte. Die wegweisenden Erkenntnisse aus Innsbruck wurden soeben im renommierten Fachjournal SCIENCE veröffentlicht.
Zoom ins Detail
Die mit der Berufung des Strukturbiologen Klaus Scheffzek an das Biozentrum (damals unter der Leitung von Lukas A. Huber) etablierte Methode der biomolekularen Kristallographie ermöglicht die detaillierte 3-dimensionale Darstellung biomolekularer Komponenten und ihrer Komplexe im Submikrometerbereich. „Wir konnten somit zeigen, dass die Untereinheit LAMTOR1 jene Klammer bildet, welche die übrigen Komponenten zusammenhält und den Proteinkomplex an das Lysosom, die mobile Müllentsorgungs- und Signalsteuerungsplattform der Zelle, heftet. RagA und RagC, zwei Signalkomponenten der G-Protein Familie, werden dadurch am Signalweg mTORC ausgerichtet und docken auf diese Weise an den lysosomalen LAMTOR-Komplex“, erklärt Klaus Scheffzek, dessen besondere Expertise auf dem Gebiet der G-Proteine – Schlüsselkomponenten in der Signalweiterleitung – liegt.
Auf Grundlage dieser strukturellen Ansicht war es nun möglich, ganz gezielt Mutationen, die den Komplex verändern und beeinträchtigen, mittels der CRISPR/CAS9 Gen-Scheren in das Erbgut von humanen Zellen einzubringen, um deren Auswirkungen in der Zellkultur nachzustellen und zu studieren. Wurde etwa die Klammer LAMTOR1 an gewissen Stellen durchtrennt, war der Komplex nicht mehr funktionsfähig. Gleichzeitig wurden jene Aminosäure-Regionen ersichtlich, welche für eine funktionsfähige Klammer verantwortlich sind. „Das Wissen um die kritischen Aminosäuren-Positionen gibt uns gleichsam eine Vorschau auf potentielle neue Medikamente, die den Komplex abschalten könnten in Erkrankungen wie Krebs oder Stoffwechselstörungen, in denen der mTORC-Signalweg überaktiv ist“ erklärt Arzt und Zellbiologe Lukas Huber.
Standortvorteil: Know-How und kurze Wege
Die neuen Erkenntnisse des Innsbrucker Teams sind das Resultat mehrerer, von unablässiger wissenschaftlicher Neugier angetriebener Forschungsjahre und nicht zuletzt auch optimaler standortstrategischer Voraussetzungen. „Es war uns im Zuge dieser Forschungsarbeit auch vor dem Hintergrund der international hochkarätigen Wettbewerbssituation ein Anliegen, räumliche Nähe und wissenschaftliche Expertisen optimal zu vereinen“, so Huber. Die aktuelle Arbeit kann zudem als Herausforderung einer bereits 2012 im Magazin Cell erschienenen Arbeit des amerikanischen Molekularbiologen und Entdeckers des mTORC Signalweges, David Sabatini, angesehen werden. „Nachdem wir nun die zellulär biologische Funktion der einzelnen Komponenten in der Signalweiterleitung besser verstehen, müssen auch die Erkenntnisse aus 2012 und damit die Regulation der Signalweiterleitung durch LAMTOR in einem neuen Licht gesehen werden“, resümiert Scheffzek.
Perspektive
Für die Weiterentwicklung der Forschungsarbeiten streben Scheffzek und Huber das Studium anderer höher geordneter Komplexe unter LAMTOR-Beteiligung an. Außerdem sollen in Zusammenarbeit mit dem Austrian Drug Screening Institut (ADSI) in Innsbruck die strukturbiologischen Erkenntnisse des Komplexes in mögliche Medikamente zur Abschaltung des in bestimmten Erkrankungen überaktiven mTORC Komplexes übersetzt werden.
Link zur Forschungsarbeit: http://science.sciencemag.org/content/early/2017/09/20/science.aao1583
PR & Medien
Pressebilder zum Herunterladen
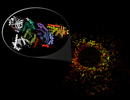
Immunfluoreszenzaufnahme des LAMTOR Komplexes (gelb) am Lysosom (rot), das Insert zeigt die Kristallstruktur des Heptameren LAMTOR Komplexes mit den G Proteinen (Copyright: Lukas Huber)
Science berichtet über die neuen Erkenntnisse von Klaus Scheffzek (l.) und Lukas A. Huber. (Copyright: Christof Lackner)

v.l.: Giridhar Shivalingaiah, Herbert Lindner, Theresia Dunzendorfer-Matt, Andreas Naschberger, Leopold Kremser, Klaus Scheffzek, Martin Offterdinger, Lukas A. Huber, Mariana E.G. de Araujo, Taras Stasyk. Nicht im Bild, weil inzw. andernorts tätig: Barbara Fürnrohr, Stefan Lechner und Stefan Welti, alle Biol. Chemie. (Copyright: Christof Lackner)
Für Rückfragen:
Univ.-Prof. Dr. Lukas A. Huber
Sektion für Zellbiologie
Tel.:+43 676 8716 72170
E-Mail: Lukas.A.Huber@i-med.ac.at
Univ.-Prof. Dr. Klaus Scheffzek
Sektion für Biologische Chemie
Tel.: +43 512 9003 70330
E-Mail: Klaus.Scheffzek@i-med.ac.at
Medienkontakt:
Mag.a Doris Heidegger
Öffentlichkeitsarbeit Medizinische Universität Innsbruck
Innrain 52, 6020 Innsbruck, Austria
Telefon: +43 512 9003 70083, Mobil: +43 676 8716 72083
public-relations@i-med.ac.at, www.i-med.ac.at
Pressebilder zum Herunterladen

Immunfluoreszenzaufnahme des LAMTOR Komplexes (gelb) am Lysosom (rot), das Insert zeigt die Kristallstruktur des Heptameren LAMTOR Komplexes mit den G Proteinen (Copyright: Lukas Huber)
Science berichtet über die neuen Erkenntnisse von Klaus Scheffzek (l.) und Lukas A. Huber. (Copyright: Christof Lackner)

v.l.: Giridhar Shivalingaiah, Herbert Lindner, Theresia Dunzendorfer-Matt, Andreas Naschberger, Leopold Kremser, Klaus Scheffzek, Martin Offterdinger, Lukas A. Huber, Mariana E.G. de Araujo, Taras Stasyk. Nicht im Bild, weil inzw. andernorts tätig: Barbara Fürnrohr, Stefan Lechner und Stefan Welti, alle Biol. Chemie. (Copyright: Christof Lackner)
Für Rückfragen:
Univ.-Prof. Dr. Lukas A. Huber
Sektion für Zellbiologie
Tel.:+43 676 8716 72170
E-Mail: Lukas.A.Huber@i-med.ac.at
Univ.-Prof. Dr. Klaus Scheffzek
Sektion für Biologische Chemie
Tel.: +43 512 9003 70330
E-Mail: Klaus.Scheffzek@i-med.ac.at
Medienkontakt:
Mag.a Doris Heidegger
Öffentlichkeitsarbeit Medizinische Universität Innsbruck
Innrain 52, 6020 Innsbruck, Austria
Telefon: +43 512 9003 70083, Mobil: +43 676 8716 72083
public-relations@i-med.ac.at, www.i-med.ac.at




