Chromatin-Protein CHD1 steuert Hungerwahrnehmung im Fliegenhirn
CHD1 kommt in allen Organismen - von der Hefe bis zum Menschen - vor. Im Gehirn sorgt es dafür, dass während des Transkriptionsprozesses die Chromatin-Verpackung der DNA stabil bleibt. Fehlt es, wird die Aktivität von Genen, die Hunger und Sättigungsgefühl steuern, nicht mehr korrekt reguliert, was zu verringerter Nahrungsaufnahme und verkürzter Lebensdauer führt, wie Innsbrucker ForscherInnen um Alexandra Lusser nun anhand von Fruchtfliegen nachweisen konnten.
Fruchtfliegen* fühlen sich immer satt, wenn in ihrem Gehirn das Protein CHD1 fehlt. Sie hören auf zu fressen und ihr Metabolismus weist starke Störungen auf. Darüber hinaus erhöhen sich kritische Entzündungsmarker und sie sterben bald. Ihre Lebenszeit von durchschnittlich 80 Tagen verkürzt sich auf ein Drittel. Das ist das Ergebnis von Untersuchungen von Alexandra Lusser und ihrem Team mit Erstautorin Ines Schoberleitner am Institut für Molekularbiologie der Medizinischen Universität Innsbruck. Die nun im hochrangigen Fachjournal Cell Reports publizierte Arbeit entstand in Zusammenarbeit mit weiteren KollegInnen am Standort sowie mit Dmitry V. Fyodorov, der am Albert Einstein College of Medicine in New York das Department für Zellbiologie leitet.
Lusser, die in einer vorangegangenen Studie bereits den entscheidenden Einfluss des CHD1-Proteins auf die Fruchtbarkeit von Drosophila nachgewiesen hat, konnte mit ihrer Untersuchung erstmals zeigen, dass CHD1 auch „sehr wichtig im Gehirn“ ist. Im Zuge weiterer Forschung soll der Frage nachgegangen werden, ob die CHD1-Expression im normalen Alterungsprozess abnimmt, die Chromatinstruktur dadurch schlechter und das gesunde Altern beeinflusst wird.
Im Detail: Beim Protein CHD1 handelt es sich um einen so genannten Chromatin remodelling factor. Er ist bei allen Organismen, von der Hefe bis zum Menschen, vorhanden und erfüllt fundamentale Aufgaben. Unter anderem ist CHD1 dafür zuständig, den Einbau von Histonvarianten in das Chromatin, die Struktur in der die DNA in der Zelle vorliegt, zu regulieren. Denn die Erbinformation liegt im Zellkern nicht lose als offenes Molekül vor, sondern wird mit Hilfe von speziellen Proteinen, den Histonen, in eine dichte Struktur verpackt. Immer wenn sich eine Zelle teilt, wird die neu gebildete DNA mit diesen Histonen beladen. „Werden Gene jedoch abgelesen im Zuge der Transkription, kann es zum Verlust von Histonen kommen, Die fehlenden Histone müssen ersetzt werden, damit es nicht zu Schäden in der DNA oder zur unerwünschten Aktivierung von Abschnitten des Genoms kommt“ erläutert Lusser. Dies geschieht einerseits während der nächsten Zellteilung und andererseits direkt während der Transkription durch den Einbau sogenannter Histonvarianten. Da sich Gehirnzellen im Laufe des Lebens praktisch nicht mehr teilen, ist der Austausch ausschließlich auf den Transkriptionsprozess beschränkt. So kommt es, dass im menschlichen Gehirn im Alter von 14 Jahren bereits ein Hauptteil der Histone Histonvarianten sind. Im vorliegenden Artikel konnten die ForscherInnen nachweisen, dass bei der Fruchtfliege im Alter von 40 Tagen ca. 40 Prozent der Histone ausgetauscht sind.
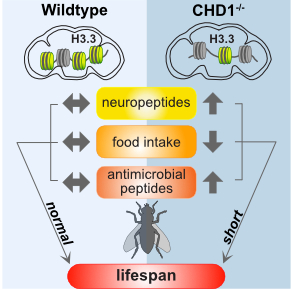
In ihren Untersuchungen mit Drosophila haben die WissenschaftlerInnen nun festgestellt, dass der Anteil der Histonvariante H3.3 im Gehirn stark reduziert ist, wenn CHD1 fehlt. Die Transkription im Gehirn gerät außer Kontrolle: „Ein Großteil der Gene wird hochreguliert, es werden mehr Gene transkribiert als normal. Durch das fehlende H3.3 wird Chromatin nicht mehr so dicht gewickelt und Genorte, die nicht transkribiert werden sollten, werden transkribiert. Gene, die bereits abgelesen werden, werden stärker abgelesen. Darunter sind viele Neuropeptide, die Hunger und Sättigung regulieren sowie antimikrobielle Peptide, die einen Teil des Immunsystems ausmachen, was zur Folge hat, dass sich die Fliege in einem konstanten Entzündungszustand befindet “, erläutert Lusser den Vorgang. Interessant: „Wenn man CHD1 wieder nur ins Gehirn einführt, werden alle Defekte behoben und die Fliegen haben eine ganz normale Lebenszeit. Das Protein wird in allen Zellen gebildet. Es kann überall fehlen, nur nicht im Gehirn. Dann geht es der Fliege gut.“
Für die Wissenschafterin ist es durchaus vorstellbar, dass sich ein CHD1-Mangel beim Menschen ähnlich auswirken könnte. Sie gibt aber zu bedenken: „Da es beim Menschen sieben CHD1-Untertypen gibt, deren Rollen und Zusammenwirken schwer einzugrenzen sind, ist der Prozess viel komplexer“.
*Forschung mit der Fruchtfliege: Drosophila wird seit mehr als hundert Jahren als Modellorganismus für die Genetik herangezogen. 75 Prozent der Gene von Drosophila sind auch im Menschen vorhanden. Deshalb gibt es Fliegenmodelle u.a. für Fragestellungen der Krebsforschung, Entwicklungsbiologie und Neurowissenschaften. Sie ist einfach genetisch zu manipulieren und es gibt unzählige Möglichkeiten sie molekularbiologisch zu untersuchen.
(12. Oktober 2021, Text: T. Mair, Fotos/Grafik: AdobeStock, Labor Lusser)
Links:
CHD1 controls H3.3 incorporation in adult brain chromatin to maintain metabolic homeostasis and normal lifespan. Cell Reports https://doi.org/10.1016/j.celrep.2021.10976
Arbeitsgruppe Lusser




