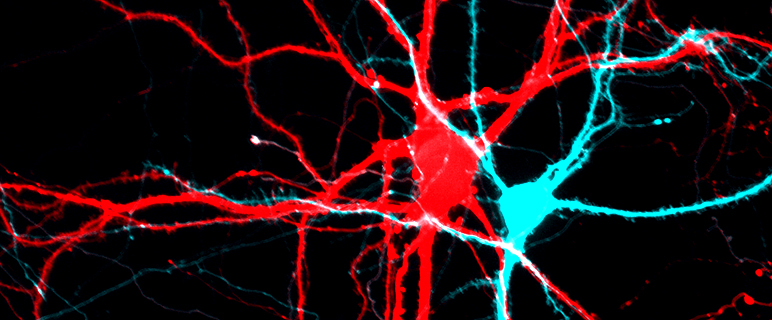
Nervenzellen völlig falsch verbunden
Einem neurowissenschaftlichen Team der Sektion für Physiologie ist es gelungen, einen neuen Mechanismus zu beschreiben, der für fehlverschaltete Verbindungen zwischen den Nervenzellen im Gehirn bei neuropsychiatrischen Erkrankungen wie Schizophrenie oder Autismus verantwortlich sein könnte. Möglich waren diese neuen Erkenntnisse nicht zuletzt durch die hochauflösende „super-resolution“ gSTED-Mikroskopie, mit der kleinste Strukturen im Inneren von Zellen untersucht werden können.
Damit Informationen im Gehirn korrekt weitergeleitet werden, stehen die Nervenzellen über zumeist chemische Synapsen miteinander im Austausch. Botenstoffe (Neurotransmitter) fungieren als Überbringer der Information, wobei dieser Botendienst in erregenden Synapsen vor allem von Glutamat und in hemmenden Synapsen von Gamma-Aminobuttersäure (GABA) erledigt wird. „Ist die Balance zwischen erregenden und hemmenden Synapsen jedoch gestört, kann das pathologische Folgen haben“, weiß der Neurophysiologe Gerald Obermair (Sektion für Physiologie), dessen neueste Erkenntnisse genau an diesem Punkt ansetzen.
Kleine Veränderung, große Wirkung
Mit seinem Team um die Erstautorin Stefanie Geisler, dem ehemaligen Mitarbeiter Clemens Schöpf und deutschen Kollegen der Westfälischen Wilhelms-Universität Münster konnte Obermair nun erstmals zeigen, dass eine erhöhte Menge eines einzigen präsynaptischen Proteins ausreicht, um Synapsen falsch zu verbinden. „Im Rahmen der Neubildung von Proteinen gibt es ja immer mehrere, durch den Vorgang des Spleißens (Splicing) entstehende Varianten. Wir haben nun eine Splice-Variante des sogenannten α2δ-2 Proteins, einer regulatorischen Untereinheit des Kalziumkanals, die in synaptischen Verbindungen vorkommt, untersucht. Dazu haben wir jeweils erregende und hemmende Gehirnzellen von neugeborenen Mäusen in speziell entwickelten Zellkulturen genetisch verändert. Nach der mehrwöchigen Entwicklung dieser Nervenzellen im Labor konnten wir durch Einfärbung sowohl prä- als auch postsynaptische Zellen gleichzeitig darstellen“, so die Erstautorin Stefanie Geisler. Mit dem super-resolution gSTED (gated stimulated emission depletion) Mikroskop, das seit mehreren Jahren an der Core Facility Biooptics genutzt werden kann und das mikroskopische Analysen von zellulären Strukturen unter 40 Nanometern Größe zulässt, war es möglich, die Verbindungen der Zellen darzustellen und zu vermessen. Die Forscher*innen konnten dabei beobachten, dass sich erregende Synapsen mit einer erhöhten Menge an α2δ-2 völlig falsch verknüpften, nämlich mit hemmenden anstatt erregenden postsynaptischen Rezeptoren. Da ähnlich falsche Verbindungen auch als Ursache von neuropsychiatrischen Erkrankungen wie Autismus und Schizophrenie diskutiert werden, kann aus dieser fehlenden Übereinstimmung ein Ungleichgewicht in der Signalübertragung entstehen. Tatsächlich konnte durch die elektrophysiologische Expertise von Ruslan Stanika aus Obermairs Team genau diese Dysbalance, also eine starke Reduktion erregender Signale, gezeigt werden.
Nachdem vier verschiedene α2δ Proteine in Synapsen vorkommen, jedes davon mehrere Splice-Varianten bildet und deren veränderte Expression bei Autismus und Epilepsie beschrieben wurde, ist das weitere Interesse des Innsbrucker Forscherteams vorprogrammiert. „Auch wenn sich die Analysen dieser komplexen Prozesse sehr aufwändig gestalten, wollen wir nun natürlich wissen, welche Auswirkungen veränderte Expressionen der anderen Varianten haben“, so Obermair. Ein direktes Folgeprojekt wird derzeit im Rahmen des doc.funds PhD Programms CavX – Calcium channels in excitable cells, als dessen Sprecher Gerald Obermair fungiert, untersucht. „Weiters ergibt sich daraus die Frage, ob dieser neue trans-synaptische Mechanismus manipulierbar ist und damit eine potenzielle Angriffsfläche für neue Therapie bieten könnte“, so Obermair, der seit März dieses Jahres auch an der Karl Landsteiner Privatuniversität für Gesundheitswissenschaften (KL) in Krems lehrt.
Die Relevanz der im Fachjournal Journal of Neuroscience publizierten Erkenntnisse aus Innsbruck wurde mit einem Feature in "This Week in The Journal" (http://www.jneurosci.org/content/39/14/2573) und mit der Auswahl des Coverbildes (http://www.jneurosci.org/content/39/14.cover-expansion) zusätzlich unterstrichen. Die erfolgreiche Durchführung dieser Forschungsarbeit wurde nicht zuletzt Dank der Förderung des FWF im Rahmen des SFB-F44 (Cell signaling in chronic CNS disorders) ermöglicht.
(D. Heidegger)
Links:
Presynaptic α2δ-2 Calcium Channel Subunits Regulate Postsynaptic GABAA Receptor Abundance and Axonal Wiring. Stefanie Geisler, Clemens L. Schöpf, Ruslan Stanika, Marcus Kalb, Marta Campiglio, Daniele Repetto, Larissa Traxler, Markus Missler and Gerald J. Obermair. Journal of Neuroscience 3 April 2019, 39 (14) 2581-2605
https://doi.org/10.1523/JNEUROSCI.2234-18.2019
Obermair Lab
https://www.i-med.ac.at/dpmp/physiologie/research/obermair/
Core Facility Biooptics
https://www.i-med.ac.at/neurobiochemistry/neurobiochemistry/Biooptics/Main.html
SFB-F44 Cell signaling in chronic CNS disorders
https://www.uibk.ac.at/pharmazie/pharmakologie/sfb-f44/
Freie PhD Stellen im CavX Programm
https://phd-school.i-med.ac.at/events/nbsp/?tx_news_pi1%5Bnews%5D=344&cHash=d5f8dddfb2d39376ed9d2b130252826d