Neue Erkenntnisse zu Langerhanszellen verbessern das Verständnis für immunregulierende Prozesse
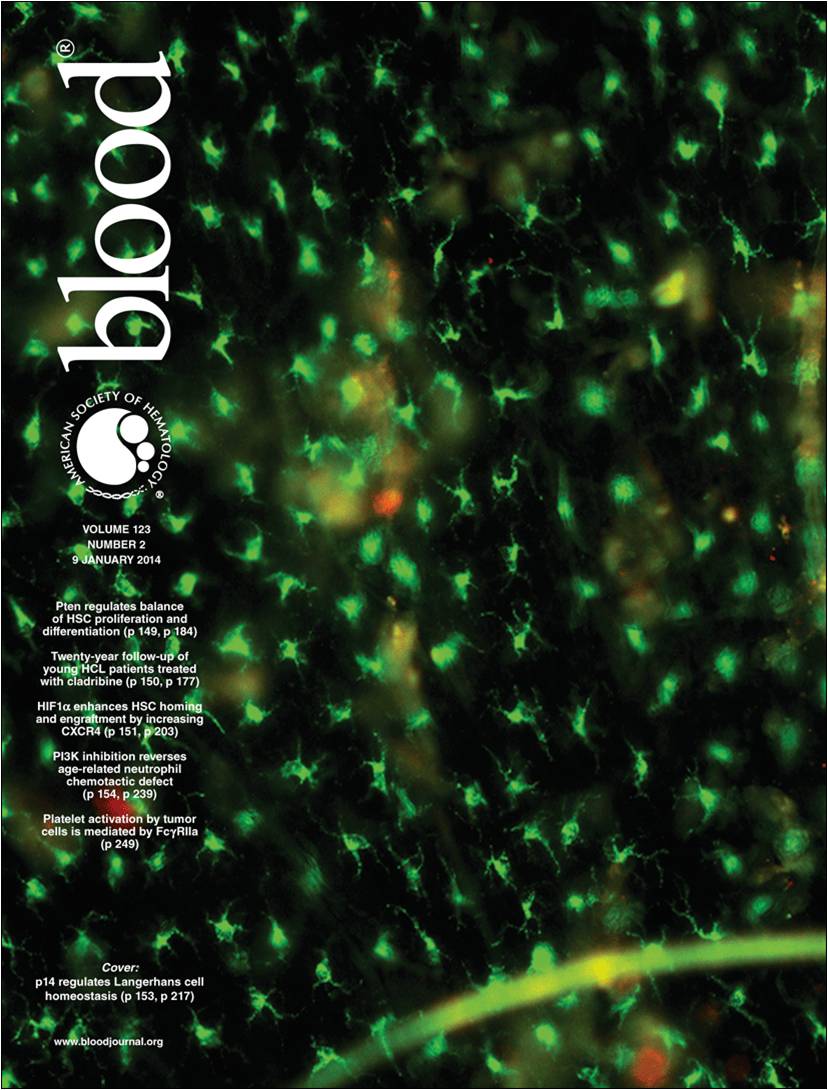
Eine kürzlich im Fachjournal BLOOD publizierte Arbeit zweier Forschungsteams aus der Innsbrucker Hautklinik und dem Biozentrum trägt entscheidend zum besseren Verständnis der Regulation des Lebenszyklus epidermaler Langerhanszellen bei. Die Bedeutung der Ergebnisse wird auch dadurch unterstrichen, dass sie dem Journal einen Kommentar – "Inside Blood" – wert waren und ein Langerhanszell-Foto von Erstautor Dr. Florian Sparber das Titelblatt des aktuellen Heftes ziert.
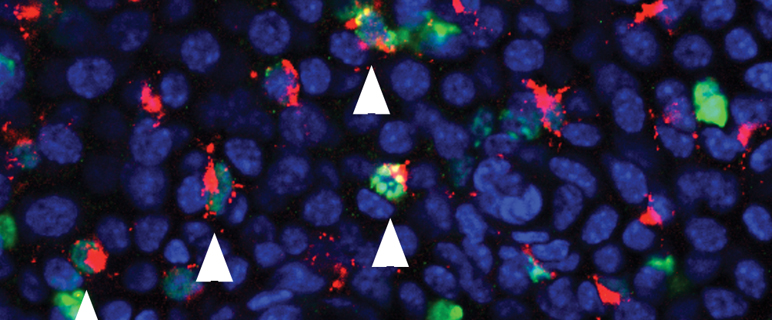
An der Univ.-Klinik für Dermatologie (Direktor Univ.-Prof. Dr. Matthias Schmuth) wird die Rolle der Dendritischen Zellen als relevante Akteure in allen Immunreaktionen des Organismus bereits seit drei Jahrzehnten intensiv erforscht. So stammen wichtige Erkenntnisse über die immunogene Funktion dieser Zellen aus den Arbeiten der Innsbrucker Gruppe um Univ.-Prof. Dr. Nikolaus Romani und Ass.-Prof.in Dr.in Patrizia Stoitzner. Das trifft insbesondere auf die epitheliale Untergruppe der Dendritischen Zelle, die sogenannte Langerhanszelle, zu. Diese hochspezialisierten Zellen bilden ein Netzwerk von dendritischen Immunzellen in der Oberhaut (Epidermis) und bereiten Antigene für die Lymphozyten auf (Antigenpräsentation), die dann die Antigen- bzw. Pathogenabwehr durchführen.
p14 trifft Langerhanszelle
Eine in synergetischer Kooperation mit dem Team um Univ.-Prof. Lukas Huber vom Innsbrucker Biozentrum entstandene und soeben im Fachjournal BLOOD veröffentlichte Arbeit gewährt nun neue Einblicke in die Homöostase der Langerhanszellen. Erstautor Dr. Florian Sparber aus dem Team um Prof. Romani konnte sich dabei auf Vorarbeiten aus dem Biozentrum stützen, die auf die Signalweiterleitung in Zellen fokussieren. Die ForscherInnen um Prof. Huber klärten in einer Reihe von Arbeiten die zellbiologische Funktion des zellulären Adaptermoleküls p14 als Teil des LAMTOR Komplexes – ein Verband aus fünf Regulatorproteinen – auf. Schon vor einigen Jahren gelang etwa der Nachweis, dass das Fehlen von p14 zu Unordnung in der Zelle führt, wodurch wichtige Akteure für die Weiterleitung von Signalen nicht mehr zur rechten Zeit am rechten Platz sind. Eine komplexe Störung des Immunsystems ist die Folge. p14 dient also vor allem der räumlichen Koordination von Signaltransduktionsprozessen an der Membran von Endosomen (intrazelluläre Vesikel). „Endosomen spielen in den Dendritischen Zellen eine wichtige Rolle bei der Aufnahme von Antigenen. Es lag daher nahe, die Rolle des p14 Moleküls speziell und exklusiv in Dendritischen Zellen zu studieren. Anhand von Mausmodellen, in denen p14 selektiv in Dendritischen Zellen bzw. in Langerhanszellen eliminiert wurde, stellten wir überraschenderweise fest, dass die epidermalen Langerhanszellen in diesen Mäusen praktisch zur Gänze fehlten“, erzählt Erstautor Sparber, der mit dieser, über vier Jahre beanspruchenden Arbeit im Rahmen des Doktoratsprogramms Molecular Cell Biology (MCB) zum PhD promovierte. Damit gelang der Nachweis, dass der Zusammenbruch des Langerhanszell-Netzwerkes durch das Fehlen von p14 und dadurch induzierte Störungen in den zentralen mTOR und ERK Signaltransduktionswegen veursacht wird, was verringerte Zellteilung und vermehrten Zelltod (Apoptose) der Langerhanszellen kurz nach der Geburt zur Folge hatte.
Aussichtsreicher Forschungsansatz
Die, gemeinsam von Ass.-Prof.in Dr.in Patrizia Stoitzner und Univ.-Prof. Dr. Nikolaus Romani geleitete und in enger Zusammenarbeit mit Univ.-Prof. Dr. Lukas Huber vom Biozentrum und seiner Mitarbeiterin und Doktorandin Dipl.-Biol.in Julia Scheffler entstandene Arbeit nahm ihren Ausgang im Rahmen eines Projekts des 2008 abgebrochenen IFTZ (Integriertes Forschungs‐ und Therapiezentrum)-Programms der Medizinischen Universität Innsbruck und wurde schließlich als FWF Projekt unter Prof. Romani weitergeführt und abgeschlossen. „Letztlich ist es durchaus vorstellbar, dass diese Erkenntnisse dazu beitragen können, Langerhanszellen therapeutisch zu manipulieren. Das könnte in Richtung Tumortherapie von Bedeutung sein, wobei hier noch weitere Untersuchungen notwendig sind. Immerhin mehren sich die Hinweise in der Literatur, dass Langerhanszellen ganz besonders geeignet sind, um Killer T Lymphozyten zu stimulieren“, blickt Prof. Romani in die immuntherapeutische Zukunft und fügt hinzu: "Voraussetzung dafür ist jedoch eine ausreichende Förderung und Subventionierung der nunmehr im Wirtschaftsministerium angesiedelten Grundlagenforschung“.
(D.Heidegger)
|
Dr. Florian Sparbers Foto ist das aktuelle BLOOD-Titelbild. |
|
|
v.l.: Erstautor Dr. Florian Sparber, Ass.-Prof.in Dr.in Patrizia Stoitzner, Univ.-Prof. Dr. Nikolaus Romani und Dr. Christoph Heinrich Tripp. |
Links:
The late endosomal adaptor molecule p14 (LAMTOR2) represents a novel regulator of Langerhans cell homeostasis. Florian Sparber, Julia M. Scheffler, Nicole Amberg, Christoph H. Tripp, Valeska Heib, Martin Hermann,Sonja P. Zahner, Björn E. Clausen, Boris Reizis, Lukas A. Huber, Patrizia Stoitzner and Nikolaus Romani. Blood. 2014 Jan 9;123(2):217-27;
http://bloodjournal.hematologylibrary.org/content/123/2/217.long
Link zum Kommentar
http://bloodjournal.hematologylibrary.org/content/123/2/153.full.pdf+html
Univ.-Klinik für Dermatologie und Venerologie
http://dermatologie.uki.at/page.cfm?vpath=index
Labor Univ.-Prof. Nikolaus Romani
http://dermatologie.uki.at/page.cfm?vpath=forschung/dendritische-zellen
Labor Ass.-Prof.in Patrizia Stoitzner
http://langerhanscell.com/Welcome.html
Labor Univ.-Prof. Lukas Huber
https://www.i-med.ac.at/cellbio/labore/sigtranslab/index.html.de
Cell Therapy Unit – Oncotyrol
http://www.oncotyrol.at/forschung/forschungsprojekte/area-3-innovative-therapies/231-cell-therapy-unit/
PhD Programm MCB
https://www.i-med.ac.at/studium/studierende/phd/mcb/
Integriertes Forschungs‐ und Therapiezentrum
https://www.i-med.ac.at/forschung/files/IFTZ.pdf