Neues Tool zur Erforschung Seltener Erkrankungen
Zur äußerst Seltenen Krankheit MVID (Mikrovillus Einschlusserkrankung) wird an der Medizinischen Universität Innsbruck gar nicht selten, sondern intensiv geforscht. Der Pädiater und Zellbiologe Georg Vogel hat in den vergangenen Jahren viel zur Aufklärung dieser angeborenen kindlichen Durchfallerkrankung beigetragen. Mit seiner rezenten Forschungsarbeit liefert er nun weitere Erkenntnisse zum Proteintransport in Darmepithelzellen – einem zentralen Mechanismus bei der Entstehung dieser lebensbedrohlichen Erkrankung.
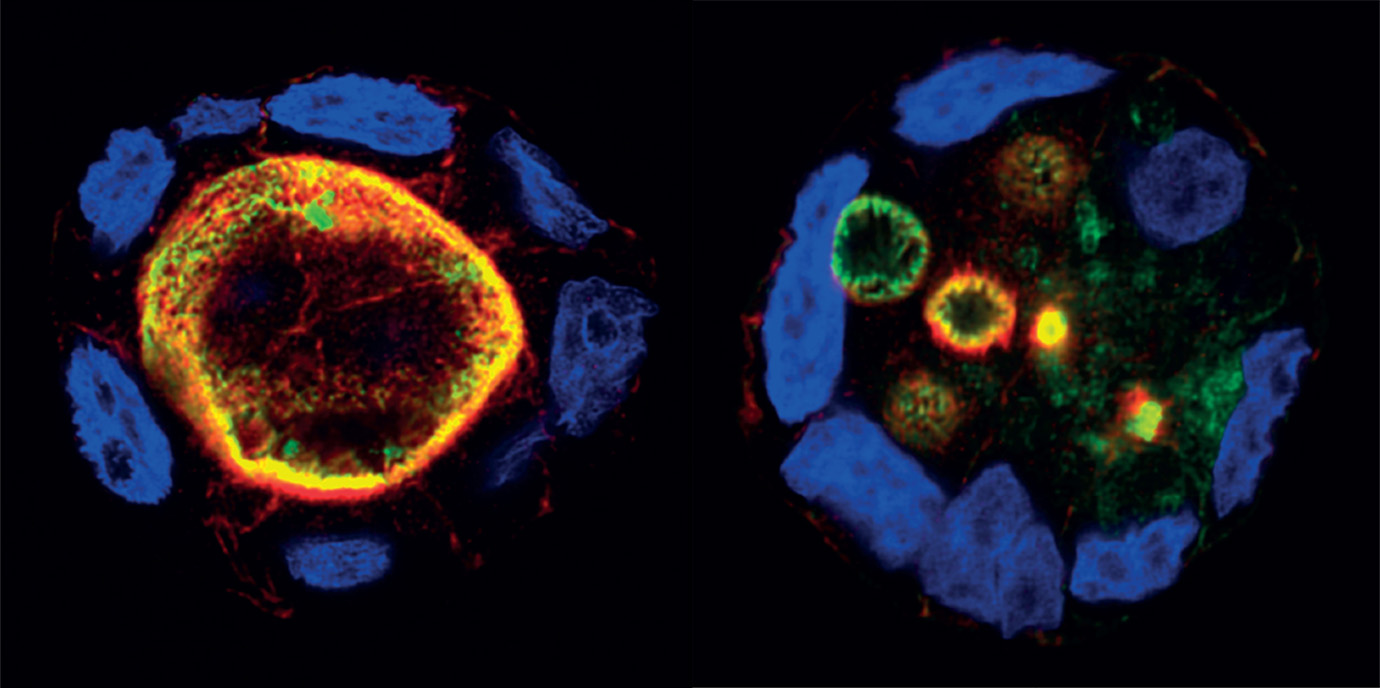
Bei der 1978 erstmals identifizierten MVID sind Struktur und Funktion des Bürstensaums im Darm (sog. Mikrovilli) schon bei der Geburt gestört, sodass Flüssigkeit und Nährstoffe nicht über den Darm aufgenommen werden können. Die kleinen PatientInnen sind durch den enormen Flüssigkeitsverlust oft in akuter Lebensgefahr und benötigen eine tägliche Infusionstherapie. In den vergangenen Jahren lieferte ein interdisziplinäres Team um Lukas A. Huber (Direktor des Instituts für Zellbiologie am Biozentrum), Thomas Müller (Direktor der Univ.-Klinik für Pädiatrie I), Andreas Janecke (Univ.-Klinik für Pädiatrie I) und Michael Heß (Institut für Histologie und Embryologie) wichtige mechanistische Einblicke in die Pathophysiologie von MVID. So wurden das Motorprotein MyosinVb und in der Folge ein Defekt im Protein Syntaxin 3 als krankheitsauslösende Mutationen identifiziert sowie auch spezifische Gentests für die rasche Diagnose entwickelt.
Georg Vogel, seit 2020 Inhaber einer Laufbahnstelle zu den „Molekularen Grundlagen seltener Erkrankungen“ – erstmals als „Brückenstelle“ zwischen dem Institut für Zellbiologie und der Univ.-Klinik für Pädiatrie angesiedelt – ist es zudem gelungen, ein einzigartiges Zellkulturmodell zu etablieren, das die krankheitsrelevanten Proteine im zellulären Kontext zeigt. Damit können die zellulären Krankheitsmuster im Labor gleichsam nachgebaut und alle phänotypischen Merkmale abgebildet werden. „Weil die zugrunde liegenden Mechanismen und involvierten Proteine noch immer nicht vollständig verstanden und einige Fragen aus den Vorprojekten noch offen sind, haben wir unser Darmepithel-Zellkulturmodell genutzt, um neue, für den apikalen* Transport relevante Proteine zu identifizieren und deren Funktion näher zu erforschen“, erklärt der Pädiater und Zellbiologe den Hintergrund des vom FWF geförderten Forschungsprojekts, das er gemeinsam mit PhD-Studentin und ÖAW Doc-Stipendiatin Katharina Klee und Michael Heß durchgeführt hat. eLife berichtet über die Ergebnisse.
Epithelzellen übernehmen verschiedenste physiologische Funktionen, die von ihrer polaren Differenzierung abhängig sind. Dafür ist unter anderem ein intrazellulärer, zur apikalen Plasmamembran gerichteter Proteintransport notwendig. Defekte dieser Mechanismen können Ursprung von Erkrankungen, wie beispielsweise angeborene Durchfallerkrankungen, sein. „In diesem Projekt haben wir den bisher ersten genomweiten CRISPR/Cas9-Screen in humanen polarisierten Epithelzellen durchgeführt und damit nahezu alle rund 19.000 proteincodierenden Gene abgedeckt, um Fehllokalisierungen des Oberflächenproteins DPP4 dadurch identifizieren zu können. So entstand eine Liste aus 89 Kandidatengenen, die zu einem Phänotyp führen. Daraus ließ sich wieder eine Subgruppe aus sieben Genen bestimmen, bei denen ähnliche zelluläre Funktionen bekannt waren, aber auch neue identifiziert werden konnten“, beschreibt Georg Vogel das methodische Herantasten an diese neuen Erkenntnisse. Nun steht ein einzigartiges und leistungsstarkes Werkzeug zur Verfügung, das sich zur Untersuchung der Polarisation und Proteinsekretion in Epithelzellen eignet. Der Datensatz dient aber auch als zukünftige Ressource für die Untersuchung neuartiger Mechanismen der epithelialen Polarisierung und des polarisierten Transports und erleichtert die Erforschung neuartiger angeborener Krankheiten im Zusammenhang mit diesen Prozessen. So könnte etwa auch die Erforschung von Erkrankungen wie die progressive familiäre intrahepatische Cholestase, kurz PFIC, profitieren, die in ihrer Pathophysiologie eines Subtyps Überschneidungen mit der MVID zeigt. Es handelt sich dabei um eine Gruppe von seltenen Lebererkrankungen, die schon im Kleinkindalter zu Leberzirrhose führen können. „Es ist nicht immer leicht den klinischen Alltag und die Forschung in Einklang zu bringen, da beides zeitintensiv ist. Jedoch ermöglichen meine beiden Tätigkeitsbereiche als pädiatrischer Gastroenterologe und Grundlagenforscher, bed to bench site Forschung zu leben. Dies wird auch von den Eltern der kleinen Patientinnen und Patienten sehr geschätzt. Bei meiner Tätigkeit kann ich immer auf die Erfahrung und Unterstützung von Lukas A. Huber und Thomas Müller bauen, das ist sehr wertvoll“, so Georg Vogel.

BU: Forschen gemeinsam zu Seltenen Erkrankungen: Thomas Müller, Georg Vogel und Lukas A. Huber (v.l., ©D.Bullock)
Auch Zellbiologe Lukas A. Huber und Pädiater Thomas Müller sind von der Ausrichtung dieser Laufbahnstelle überzeugt, die erstmals zwischen einer Klinik und einem Grundlagenforschungsinstitut angesiedelt wurde, womit ein wichtiger Akzent für die weitere Stärkung und Entwicklung des Forschungsbereichs Seltene Erkrankungen gesetzt wurde. Die jahrelange, erfolgreiche Zusammenarbeit werde durch die doppelt zugewiesene Laufbahnstelle nochmals gestärkt. „Diese gelebte Zusammenarbeit kann auch als ‚Role-Model‘ für weitere Verzahnungen von theoretischer und klinischer Forschung am Campus der Med Uni dienen“, betont Huber. Thomas Müller ergänzt: „Die Brückenstelle hat geholfen, klinische Forschung und molekulare Zellbiologie zum Wohle der Patientinnen und Patienten einzigartig zu vereinen“.
*) apikal: zur Oberfläche bzw. nach außen gerichtet; das Dünndarmepithel besitzt an seiner apikalen, zum Darmlumen zeigenden Seite einen Bürstensaum aus Mikrovilli. Auf der basalen Seite fehlen diese Mikrostrukturen. Hier grenzt das Epithel an das Bindegewebe.(06.03.2023, Text: D. Heidegger, Bilder: G.Vogel/D.Bullock)
Links:
A CRISPR screen in intestinal epithelial cells identifies novel factors for polarity and apical transport. Katharina MC Klee et al. jan 20, 2023, eLife. https://doi.org/10.7554/eLife.80135
News-Archiv: Prof. Ernst Brandl-Preis für jungen Pädiater Georg-Friedrich Vogel