Blick in die Zelle: Neu entdeckter Mega-Proteinkomplex bietet Angriffspunkte für die Therapie seltener Stoffwechselerkrankungen
Einem internationalen ForscherInnenteam, darunter ZellbiologInnen der Medizin Uni Innsbruck, ist es erstmals gelungen, einen überdimensionalen Mega-Proteinkomplex und seine Interaktion mit TFEB (Transkriptionsfaktor EB) mit atomarer Auflösung zu beschreiben – eine Erkenntnis, die für die Aufklärung der Entstehung seltener Stoffwechselerkrankungen, aber auch von neurodegenerativen Krankheiten und Krebs bedeutsam ist und therapeutisches Potenzial birgt. Das Fachjournal Nature berichtet.
mTORC1-TFEB-Rag-Ragulator nennt sich der riesige, neu entdeckte Komplex, zu dem sich insgesamt 36 einzelne Proteine unter bestimmten Bedingungen vorübergehend zusammenfinden, und der in seinem Aufbau der Form eines Schmetterlings gleicht. In dieser Zusammensetzung entscheidet der Komplex über Auf- oder Abbau wichtiger Zellbestandteile und kontrolliert damit wichtige Aufgaben im zellulären Stoffwechsel, die in der Entstehung von seltenen Krankheiten oder Krebs eine relevante Rolle spielen.

Um die atomare Struktur dieses Proteinkomplexes aufzuklären, haben sich ForscherInnen der Universität von Kalifornien in Berkley, des Baylor College für Medizin in Houston, Texas, des Telethon Instituts in Neapel und des Instituts für Zellbiologie am Biozentrum der Medizinischen Universität Innsbruck modernster Technologien zur Aufreinigung der einzelnen Proteinkomplexe bedient. Zum Einsatz kam dann die Kryo-Elektronenmikroskopie. Die nun im Fachjournal Nature publizierten Ergebnisse basieren auf früheren Forschungsarbeiten, in denen die Teams aus Berkeley, Houston, Neapel und Innsbruck* bereits einzelne Komponenten und Akteure dieser intrazellulären Maschinerie identifizieren konnten und auf diesem Weg auch für die aktuelle Forschungsarbeit zusammenfanden.
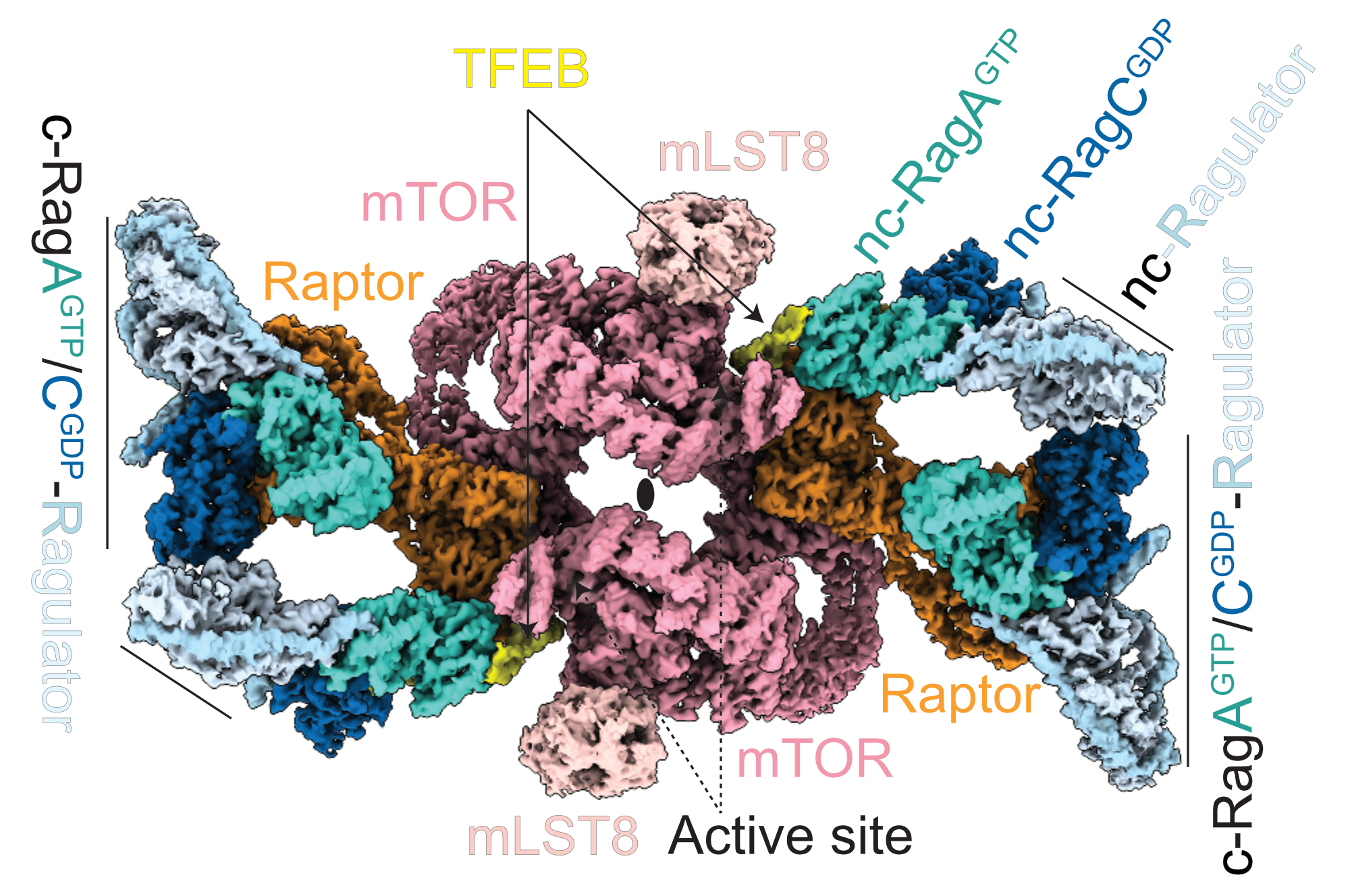
BU: Struktur des Mega-komplexes. Die einzelnen Komponenten und Subkomplexe sind in unterschiedlichen Farben dargestellt. ©Nature
„Der neue Megakomplex sitzt an der Membran von sogenannten Lysosomen. Die Forschung der letzten Jahre, auch hier in Innsbruck, hat gezeigt, dass diese Zellorganellen nicht nur so etwas wie Abfallkübel für alte, unbrauchbar gewordene Zellbestandteile sind, sondern vielmehr agieren sie als regelrechte Schaltzentralen in der Zelle“, berichtet Lukas A. Huber, Direktor des Instituts für Zellbiologie am Biozentrum der Medizin Uni Innsbruck, der mit seiner Mitarbeiterin Mariana Araujo maßgeblich an den neuen Erkenntnissen beteiligt war.
Lysosomen messen den Ernährungszustand der Zelle und stellen fest, ob genügend unterschiedliche Stoffwechselprodukte für die Aufrechterhaltung des Zellstoffwechsels vorhanden sind; gibt es zu wenig davon, dann wird der Monster-Komplex abgebaut, sodass neue Lysosomen produziert werden können. „Das Außergewöhnliche an diesem Prozess ist die Mitwirkung eines weiteren Players: des Transkriptionsfaktors TFEB. Dieser führt erst dazu, dass der Megakomplex überhaupt gebildet wird, und kontrolliert durch das An- und Abschalten bestimmter Gene, ob Lysosomen abgebaut oder neu produziert werden“, so die Zellbiologin Mariana Araujo.
Diese TFEB abhängige, außergewöhnliche Regulation könnte eine neue Andockstelle für die therapeutische Nutzung, unter anderem bei lysosomalen Speicherkrankheiten, eröffnen. Unter diesem Sammelbegriff werden Stoffwechselerkrankungen verstanden, die auf eine fehlerhafte oder unzureichende Funktion der Lysosomen zurückzuführen sind. „Ein Mehrwert aus unserer Erkenntnis könnte darin liegen, die Bindung von TFEB an den Proteinkomplex zu unterdrücken, sodass mehr oder noch funktionsfähigere Lysosomen gebildet werden können. Darüber hinaus können diese Erkenntnisse auch als neue Therapiemöglichkeit dienen, um die für neurodegenerative Erkrankungen typischen Proteinaggregate im Lysosom loszuwerden“, so Lukas A. Huber, der gemeinsam mit KollegInnen der Kinderklinik und des Instituts für Humangenetik am Standort bereits seit vielen Jahren äußerst erfolgreich an angeborenen Seltenen Erkrankungen forscht.
*) Eine der Komponenten des neuen Mega-Komplexes, der LAMTOR-Proteinkomplex, wurde bereits vor Jahren u.a. durch die Arbeitsgruppe des Tiroler Zellbiologen Lukas A. Huber identifiziert bzw. in Innsbruck erstmals dessen atomare Struktur aufgeklärt. Es handelt sich um einen Verband aus fünf derzeit bekannten Gerüst- und Regulatorproteinen, der eine Vielzahl wichtiger Vorgänge in der Zelle steuert und als Schaltweiche für zwei zentrale, in der Krebsentstehung hyperaktive, Signalwege verstanden werden kann.
(25.01.2023, Text: D. Heidegger)
Weiterführende Informationen und Links:
Structure of the lysosomal mTORC1–TFEB–Rag–Ragulator megacomplex. Cui, Z., Napolitano, G., de Araujo, M.E.G. et al. Nature (2023)
https://doi.org/10.1038/s41586-022-05652-7
Research briefing article: https://www.nature.com/articles/d41586-022-04538-y
Video zum Aufbau des Mega-Komplexes:
Vorarbeiten der ForscherInnen:
https://www.science.org/doi/epdf/10.1126/science.aao1583
https://www.nature.com/articles/s41586-020-2444-0
https://www.science.org/doi/10.1126/science.aax0364
Biocenter Innsbruck
Institut für Zellbiologie
Labor Ballabio
Labor Hurley




