Zellzykluskontrolle: neue Einblicke in frühes Krebsgeschehen
Für das „PIDDosom“, einen Komplex aus den Proteinen, PIDD1, RAIDD und der Protease Caspase-2, konnte das Team um den Entwicklungsimmunologen Andreas Villunger am Biozentrum bereits wichtige Kontrollfunktionen bei fehlerhafter Zellteilung aufzeigen. In zwei rezenten Forschungsarbeiten liefern die ForscherInnen nun weitere Details, die im Zusammenhang mit den in polyploiden Zellen in Überzahl vorkommenden Zentrosomen und mit der Tumorzelldichte als neuartigem Prognosemarker bei Leberkrebs stehen.
Fehler im Prozess der Zellteilung (Zytokinese) können zur Entstehung von Zellen mit vielfachem Chromosomensatz beitragen – ein polyploider Zustand, der zu chromosomaler Instabilität und „Aneuploidie“, also einer ungleichen Chromosomen-Verteilung führen kann. Diese Form der genetischen Instabilität ist auch Merkmal vieler Tumorzellen. Das PIDDosom nimmt hier eine wichtige regulatorische Rolle ein, da es die Teilung von Zellen mit extra Zentrosomen verhindern kann.
Neuer Mitspieler
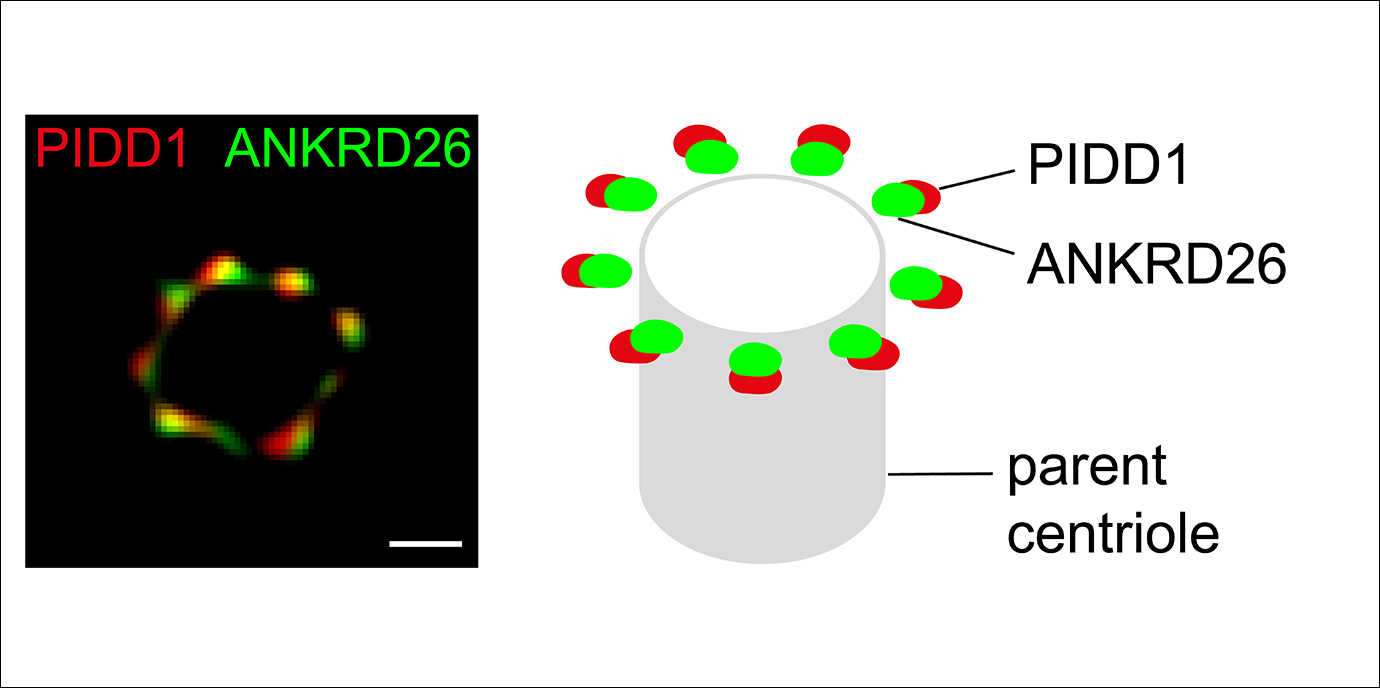
Vorarbeiten zur Aktivierung des PIDDosoms nach unvollständiger Zellteilung lieferte Luca Fava in seiner Zeit als EMBO-Fellow im Team von Andreas Villunger. Inzwischen leitet er sein eigenes Labor am Zentrum für Integrative Biologie (CIBIO) in Trient. In seiner kürzlich veröffentlichten Arbeit in The EMBO Journal stellte er sich mit seinem neuen Team die Frage, wie PIDD1 mit Zentrosomen interagiert. Zentrosomen sind strukturgebende Zellbestandteile, die für die gleichmäßige Verteilung von Chromosomen verantwortlich sind und während der Zellteilung ebenfalls voneinander getrennt werden. Bei unvollständiger Teilung verbleiben zwei Zentrosomen in der nun polyploiden Zelle, die sich vor der nächsten Teilung wieder verdoppeln und damit oft eine ungleichförmige Verteilung von Chromosomen bedingen kann. Luca Fava gelang es nun, einen weiteren Spieler in diesem Geschehen zu identifizieren. „Wir konnten inzwischen nachweisen, dass das Protein ANKRD26 eine wichtige Rolle einnimmt, da es PIDD1 ans Zentrosomen bindet. Somit gibt es auch keine Aktivierung von Caspase-2 und keine Stabilisierung des Tumorsupressors p53 mehr, wenn ANKRD26 fehlt. Zellen mit extra Zentrosomen können sich dann ungehindert weiter teilen und laufen so Gefahr, aneuploid zu werden“, beschreibt Luca Fava den neuen Mechanismus, der eine weitere Lücke im Verständnis des frühen Krebsgeschehens schließt, wie das auch vom EMBO Journal extra hervorgehoben wird (Centrosomes: Please keep your social distance!)
Neuer Prognosemarker?
In der gesunden Leber sind mehrheitlich polyploide Zellen zu finden. Dass auch hier das PIDDosom den Grad der Polyploidie sowie die Zellproliferation reguliert, konnte Valentina Sladky, MCBO-Absolventin im Team von Andreas Villunger und inzwischen selbst EMBO-PostDoc Fellow an der Johns Hopkins University in Baltimore, bereits in ihrer mehrfach ausgezeichneten Doktorarbeit nachweisen. In Innsbruck überprüfte sie noch die These, ob der Zentrosomenüberhang und erhöhte DNA-Gehalt in den polyploiden Leberzellen auch die Tumorentstehung fördert. Die überraschenden Erkenntnisse wurden letzthin in EMBO Reports publiziert und von einem der führenden Leberexperten extra vorgestellt (siehe: Hepatocyte ploidy modulation in liver cancer. Andrew W. Duncan)
„Zellen mit erhöhtem DNA-Gehalt sind ja in der Leber Teil der normalen Entwicklung, wie auch bei der Regeneration. Um den Einfluss auf die Tumorentwicklung zu untersuchen, haben wir uns eines Karzinogen-getriebenen Lebertumor-Modells bedient: In Abwesenheit des PIDDosoms ist der durchschnittliche DNA-Gehalt wie auch die Anzahl der Zentrosomen in Hepatozyten viel höher, sodass es naheliegen würde, dass Tumoren in der Leber schneller entstehen sollten“, erklärt Sladky die Ausgangssituation.
Doch Sladky und ihre KollegInnen wurden vom Gegenteil überzeugt: Die Tumorbelastung erwies sich im Leberkrebsmodell als niedriger. Je höher der DNA-Gehalt, desto resistenter erwiesen sich die Zellen gegen eine Tumorbildung – ein Phänomen, das im vergangenen Jahr auch andere Forschungsgruppen beobachteten. „Ein hypothetischer Grund könnte darin liegen, dass die Leber als Entgiftungsorgan mit vielen karzinogenen Substanzen umgehen muss“, vermutet Andreas Villunger, der auch am CeMM (Research Center for Molecular Medicine of the Austrian Academy of Sciences) forscht und diese Verbindung nutzte, um gemeinsam eine große Zahl von Lebertumorproben zu vergleichen. Um zu hinterfragen, ob ein hoher DNA-Gehalt (Ploidie) auch beim Menschen als prognostischer Marker gelten könnte, wurden 200 Tumoren vermessen und die Dichte von Zellen in bestimmten Tumorabschnitten mit gesundem Gewebe verglichen. „Eine hohe Zelldichte impliziert kleinere Zellen und einen geringeren DNA-Gehalt. Auf Basis unsere Befunde in Mäusen würde dies eine schlechtere Prognose bedeuten“, so Villunger. Eine Annahme, die letzthin auch bestätigt werden konnte. Wenn also der Primärtumor aus wenigen großen Zellen bestanden hat, war die Prognose selbst bei PatientInnen mit Lebertransplantation vorteilhaft. Der Zusammenhang von Tumor-Zelldichte und Überleben konnte somit als unabhängiger prognostischer Marker bestätigt werden. Ob die Zellgröße bereits im gesundem Lebergewebe prognostisch relevant ist und das Risiko, Leberkrebs zu entwickeln, vorhersagen kann, sollen weitere Untersuchungen zeigen.
Die Forschungsarbeiten wurden im Rahmen des ERC Advanced Grant Projekts POLICE unterstützt.
(26.01.2021, Text: D. Heidegger, Bild: L. Fava /Aufgenommen von Martin Offterdinger am SP8 Mikroskop der Core Facility Biooptics, CCB, Med Uni Innbsruck)
Links:
Centriolar distal appendages activate the centrosome‐PIDDosome‐p53 signalling axis via ANKRD26. Matteo Burigotto, Alessia Mattivi, Daniele Migliorati, Giovanni Magnani, Chiara Valentini, Michela Roccuzzo, Martin Offterdinger, Massimo Pizzato, Alexander Schmidt, Andreas Villunger, Stefano Maffini, Luca L Fava. EMBO J (2020) e104844
PIDDosome‐induced p53‐dependent ploidy restriction facilitates hepatocarcinogenesis. Valentina C Sladky, Katja Knapp, Tamas G Szabo, Vincent Z Braun, Laura Bongiovanni, Hilda van den Bos, Diana CJ Spierings, Bart Westendorp, Ana Curinha, Tatjana Stojakovic, Hubert Scharnagl, Gerald Timelthaler, Kaoru Tsuchia, Matthias Pinter, Georg Semmler, Floris Foijer, Alain de Bruin, Thomas Reiberger, Nataliya Rohr‐Udilova, Andreas Villunger. EMBO Rep (2020)21:e50893
Institut für Entwicklungsimmunologie
myPoint-Archiv:
Neues Therapie-Target für die Leberregeneration