Wie die mitochondrielle Membran-Architektur reguliert wird
Forscherinnen und Forscher des Instituts für Humangenetik (Direktor: Johannes Zschocke) der Medizinischen Universität Innsbruck haben mit selbst entwickelten Verfahren die Regulation der Lipid-Zusammensetzung von mitochondriellen Membranen unter die Lupe genommen. In der Fachzeitschrift Cell Reports demonstrieren sie, wie weitreichend die dabei identifizierten Mechanismen sind.
Mitochondrien, den meisten als Kraftwerke der Zellen bekannt, sind einzigartige Organellen in der Zelle, die neben der Energieproduktion noch für viele weitere Prozesse in unserem Körper verantwortlich sind. Einzigartig deshalb, weil sie neben ihrer eigenen DNA auch zwei Doppelmembranen besitzen, welche wiederum ein einzigartiges Lipid, das Cardiolipin, beherbergen.
Ungewöhnliche Struktur und viele Funktionen
Dieses Lipid kommt fast ausschließlich in der inneren mitochondriellen Membran vor und erfüllt mit seiner ungewöhnlichen Struktur - es hat vier anstatt der üblichen zwei Fettsäuren - eine Vielzahl an Funktionen. Zum Beispiel verankert und stabilisiert es viele Enzyme und Enzyme-Komplexe – auch die unserer Atmungskette – sicher in der Membran und schützt so vor oxidativen Schädigungen. Ebenso sind Cardiolipine essentiell für den koordinierten Zelltod, die Apoptose. Daher sind Cardiolipine auch von besonderem Interesse in der Krebsforschung, Immunologie und Alternsforschung.
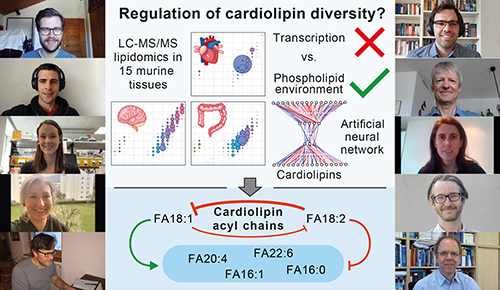
BU: Die Erstautoren Gregor Ömer und Jakob Koch (oben links) mit KollegInnen. Die Graphik verdeutlicht die gefundene Regulation der Cardiolipine.
Die hohe Variabilität von Cardiolipinen stellte WissenschafterInnen aber bislang vor ein weitgehend ungelöstes Rätsel. Verschiedene Organismen und auch unterschiedliche Organe weisen zum Teil völlig anders geartete Zusammensetzungen von Cardiolipinen auf, haben aber trotzdem voll funktionelle Mitochondrien. Ein gänzlich anderes Bild zeigt sich jedoch im Krankheitsfall, wie zum Beispiel dem Barth Syndrom, bei dem Veränderungen der Cardiolipin-Zusammensetzung zu lebensbedrohenden Symptomen wie schwerer Muskelschwäche, Kardiomyopathie und Neutropenie führen.
Um diesem Paradoxon auf den Zahn zu fühlen, haben Forscherinnen und Forscher um den Biochemiker Markus A. Keller vom Institut für Humangenetik mit Hilfe hochauflösender Massenspektrometrie die Regulation dieses spezifischen Lipids in einer Multi-Organstudie in Mäusen untersucht.
Spezifischer Mechanismus
„Entgegen manch bestehender Hypothese konnten wir zeigen, dass die Cardiolipin-Architektur nicht direkt durch Gen-Regulation gesteuert wird. Stattdessen entdeckten wir einen Spezifitäts-Mechanismus, bei dem die exakte Zusammensetzung von Cardiolipinen durch andere Phospholipide in der Zelle bestimmt wird“, berichtet Keller, dessen Team unter Verwendung von maschinellem Lernen (artifizielle neuronale Netzwerke) zudem zeigen konnte, dass der gefundene Mechanismus universell ist und somit für alle untersuchten Organe und Gewebe der Maus, aber auch für in vitro kultivierte Säugerzellen gleichermaßen gilt. „Damit beweisen wir“, so Keller, „dass das Zusammenwirken der Verfügbarkeit von bestimmten Lipiden mit dem organspezifischen Stoffwechsel für die genaue Zusammensetzung der mitochondriellen Membranen ausschlaggebend ist, und nicht der eigentliche Cardiolipin-Stoffwechsel selbst.“
Diese Erkenntnis hat weitreichenden Folgen für unser Verständnis von Cardiolipin-(Ver)änderungen, die in schwerwiegenden Erkrankungen wie etwa Alzheimer und Krebs, aber natürlich auch Barth Syndrom beobachtet wurden. Die von der Forschungsgruppe um Markus A. Keller entwickelten Modelle erlauben nun zu unterscheiden, ob diese pathologischen Veränderungen Cardiolipin-spezifisch oder auf andere Änderungen im Lipidstoffwechsel zurückzuführen sind. Dies ermöglicht nun eine umfassende Interpretation von Pathomechanismen bei genetischen sowie multifaktoriellen Erkrankungen, welche mitochondrielle Funktionen beeinträchtigen.
Infobox
Cardiolipin ist ein mitochondrielles Phospholipid, welches eine dimere Struktur mit vier anstatt der üblichen zwei Fettsäurenseitenketten hat. Die exakte Zusammensetzung wird nicht durch die Biosynthese, sondern durch enzymatisches Remodeling (= Austausch der Seitenketten) bestimmt. Cardiolipine haben den höchsten Anteil an essentiellen Fettsäuren aller Phospholipide und beeinflussen zahlreiche mitochondrielle Funktionen.
(04.05.2020, Text: Red/D. Heidegger, Bilder: Wohlfahrter, Keller)
Links:
Phospholipid Acyl Chain Diversity Controls the Tissue-Specific Assembly of Mitochondrial Cardiolipins. Oemer G, Koch J, Wohlfarter Y, Alam MT, Lackner K, Sailer S, Neumann L, Lindner HH, Watschinger K, Haltmeier M, Werner ER, Zschocke J, Keller MA. Cell Rep. 2020 Mar 24;30(12):4281-4291.e4.