Innovatives Wirkstoffdesign für die Modulation von Transkriptionsfaktoren
Die Entwicklung kleinmolekularer Substanzen, die an einen spezifischen und im Krebsgeschehen des kindlichen Neuroblastoms relevanten FOXO Transkriptionsfaktor binden, schien bis vor kurzem unrealisierbar. Einem Team des Molekularbiologischen Forschungslabors (Univ.-Klinik für Pädiatrie I) gelang nun die erstmalige exakte Beschreibung von entsprechenden „small compounds“ und damit der Coup, die Aktivität des FOXO Transkriptionsfaktors effizient zu modulieren.
FOXO-Transkriptionsfaktoren spielen ein wesentliche Rolle bei Zelltod und Stress-Resistenz und haben sich auch als sogenannte „Longevity“-Gene einen Namen gemacht. Sie gelten zudem als Homöostase-Regulatoren, die in manchen Krebsarten zur Metastasierung, zum Replikationspotential von Tumorstammzellen und zur Chemotherapie-Resistenz beitragen. FOXO3 bzw. dessen Hemmung – seit Jahren im Fokus des Molekularbiologen und Laborleiters Michael Außerlechner und seiner Kollegin Judith Hagenbuchner – spielt auch bei der Entwicklung der Chemotherapie-Resistenz in Neuroblastomzellen eine relevante Rolle.


Bilder (li): Michael Außerlechner leitet das Molekularbiologische Forschungslabor, (re): Erstautorin Judith Hagenbuchner.
Wider Erwarten bindungsfähig
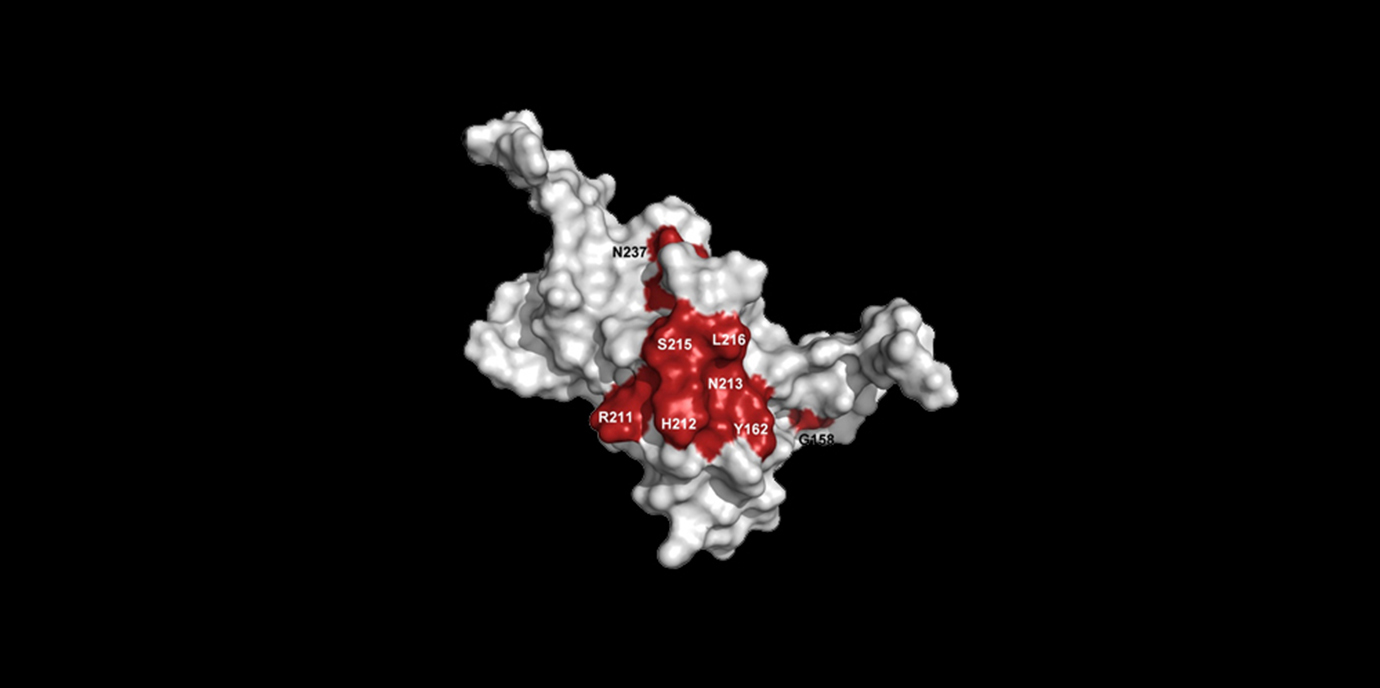
Im Rahmen einer internationalen Forschungskooperation mit BiophysikerInnen, StrukturbiologInnen und ChemikerInnen der Universität Prag und der Tschechischen Akademie der Wissenschaften versuchten Michael Außerlechner und Judith Hagenbuchner nun, ihre bereits im Vorfeld identifizierten Kandidatensubstanzen weiter zu charakterisieren und zu optimieren. „Über sogenanntes Pharmakophor-Modelling und in silico compound screening konnten wir bereits vor einigen Jahren in Zusammenarbeit mit der Pharmazie in Innsbruck Kandidatensubstanzen entdecken, die theoretisch in die DNA-Bindedomäne des Transkriptionsfaktors FOXO3 passen“, erzählt Außerlechner über das Forschungsvorhaben, das sich über mehrere Jahre erstreckte. „Weil der DNA-bindende Bereich von FOXO3 jedoch sehr groß ist und nur Kristallstrukturen mit dem entsprechenden DNA-Molekül als Ligand bekannt waren, schien dieser Bereich von Transkriptionsfaktoren nicht als Interaktionsfläche für chemische Substanzen geeignet – mit ein Grund, warum unsere Forschungsanträge zu diesem Thema anfänglich ständig abgewiesen wurden“, so Außerlechner.
„Mode of Binding“ aufgeklärt
Zum pharmakologischen Modelling, also der räumlichen (welches Volumen wird ausgefüllt) und der chemischen (welche Wechselwirkungen sind möglich) Beschreibung des „optimalen Inhibitors“ nutzte das Forschungsteam die Möglichkeit, große Datensätze mit den Strukturen chemischer Substanzen von kommerziellen Anbietern aus dem Netz herunterzuladen und schließlich am Computer mögliche Kandidatensubstanzen anhand der theoretischen Modelle herauszufiltern. „So konnten wir letztendlich jene Kandidaten finden, die mit gewisser Wahrscheinlichkeit genau in die gesuchte Proteintasche passen und damit die Bindung des Proteins an die DNA modulieren. Mit der Etablierung von biochemischen und zellbiologischen Assays war es dann möglich, die Modulation der transkriptionellen Aktivität zu belegen“, berichtet Erstautorin Judith Hagenbuchner aus ihrer in eLife publizierten Forschungsarbeit.
Um den Effekt der neu geschaffenen Modulierbarkeit auf FOXO3-mediierte Chemotherapie-Resistenz im Detail aufzuklären und das Anwendungspotential dieser „small compounds“ weiter auszuleuchten, werden derzeit 3D-biogedruckte Gewebemodelle entwickelt.
(D. Heidegger, 12.02.2020)
Links:
Molekularbiologisches Forschungslabor
3D-Bioprinting Labor der Medizinischen Universität Innsbruck