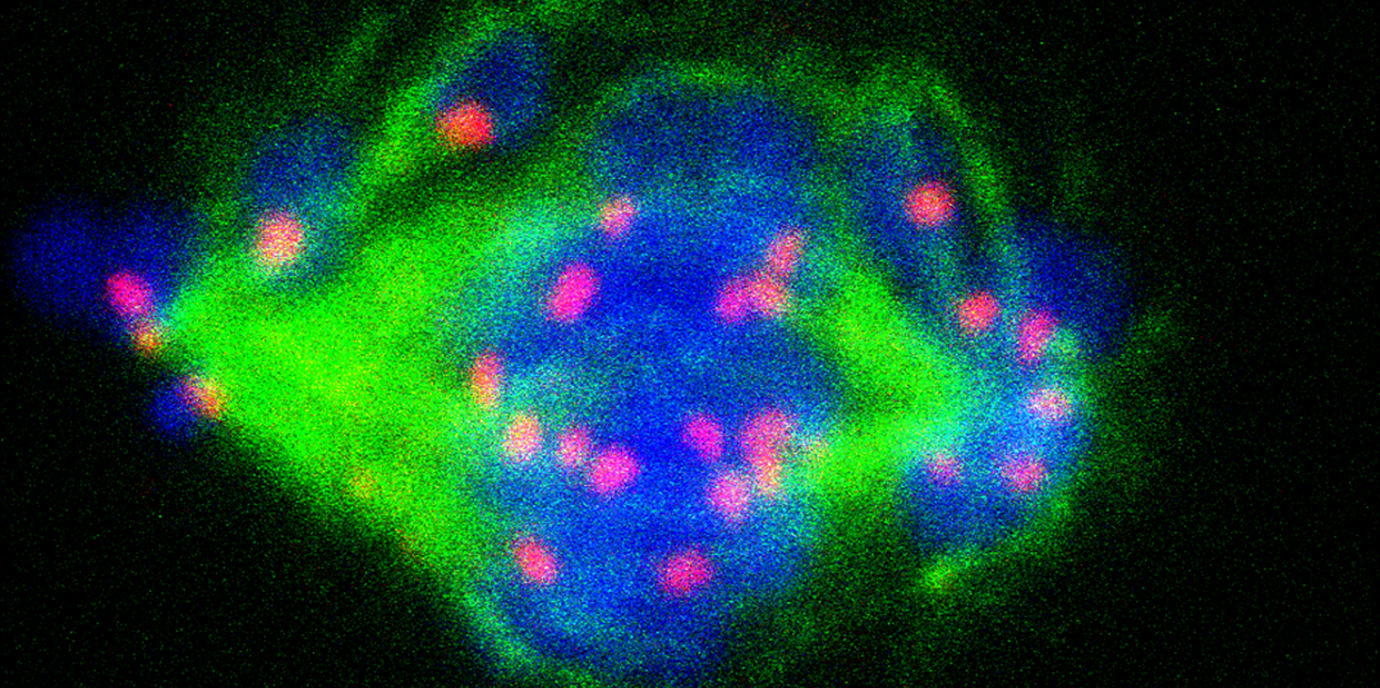
Zellteilung: Kleine Modifikation mit großer Wirkung
Eine rezente Forschungsarbeit des Teams um die Molekularbiologin Alexandra Lusser gewährt neue Einblicke in den Aufbauprozess des Zentromers. Dieser spezifische Abschnitt an den Chromosomen erfüllt essentielle Funktionen während der Zellteilungsprozesse. Erstautor und MCBO-Doktorand Anming Huang gelang nun die Entdeckung, dass Phosphorylierung des Zentromerproteins CENP-A eine zentrale Rolle dabei spielt, dass CENP-A exklusiv am Zentromer eingebaut wird.
Durch die Zentromere wird die exakte Aufteilung der Chromosomensätze auf die Tochterzellen gewährleistet. Weil der Aufbau und die Beladung des Zentromers auch in Krebszellen eine kritische Rolle spielt, ist ein besseres Verständnis dieses zentralen Vorgangs der Zellteilung besonders wichtig. „Wir wissen, dass in vielen Krebszellen z. B. zusätzlich Zentromere auf den Chromosomen entstehen können, was oft dazu führt, dass solche Chromosomen bei der Zellteilung fragmentiert und mit anderen Chromosomen fusioniert werden. Mit jedem neu identifizierten Detail der Prozesse, die den korrekten Aufbau des Zentromers steuern, könnte auch ein neues therapeutisches Target gefunden werden“, erklärt Alexandra Lusser, Leiterin des Chromatin- und Epigenetik Labors am Institut für Molekularbiologie (Direktor: Hubertus Haas).

BU: Alexandra Lusser mit Erstautor Anming Huang.
Neuer Akteur im Beladungsprozess
Den Beladungsprozess des Zentromers, an dem mehrere Proteinkomplexe beteiligt sind, untersuchten Erstautor Anming Huang und seine KollegInnen aus dem Team um Alexandra Lusser im häufig eingesetzten und gut übertragbaren Drosophila-Modell (Fruchtfliege). „Auch wenn dieser Prozess im menschlichen Organismus anders ablaufen sollte, liefern uns die Untersuchungen in der Fruchtfliege zumindest Ansätze, wie bestimmte biologische Prozesse in humanen Zellen funktionieren könnten“, schickt Alexandra Lusser voraus.
Schon in einer vorangegangenen Forschungsarbeit fokussierte sich das Team auf CENP-A, eine Variante des Histons H3, die nur im Bereich des Zentromers zu finden und für die spezifische Struktur dieser Chromosomenregion essentiell ist. Ebenfalls in Drosophila konnten die ForscherInnen damals zeigen, dass CENP-A mit Hat1, einem hochkonservierten Protein, einen Komplex bildet und dieses für den Transport und die Beladung des Zentromers beansprucht.
„Nachdem wir gefunden haben, dass CENP-A posttranslational durch Phosphorylierung und Azetylierung modifiziert ist, haben wir uns gefragt, welche Rolle die Modifikationen in diesem Prozess spielen“, beschreibt Molekularbiologe Anming Huang, der aus China kommt und hier sein Doktorat absolviert, die Ausgangslage für die neue Forschungsarbeit. Mittels verschiedener zellbiologischer und biochemischer Techniken gelang es ihm einerseits Casein Kinase II als das Enzym zu identifizieren, welches Serin 20 in CENP-A phosphoryliert, und andererseits die Funktion der Serin 20 Phosphorylierung zu beschreiben. „Für die Zelle ist es von entscheidender Bedeutung, dass CENP-A in genau limitierten Mengen hergestellt wird. Kommt es zu einer Erhöhung der CENP-A Konzentration, wie das z.B. in manchen Krebszellen der Fall ist, wird es nicht nur am Zentromer sondern auch an anderen Stellen entlang der Chromosomen eingebaut, was zu fehlerhafter Aufteilung der Chromosomen während der Mitose führt. Die Phosphorylierung an Serin 20 reguliert nun die Menge an CENP-A indem sie dazu führt, dass überschüssiges CENP-A durch das Proteasom abgebaut wird. Dies betrifft nicht nur neu synthetisiertes CENP-A sondern erfolgt auch an CENP-A, welches bereits inkorrekt an Chromosomenregionen außerhalb des Zentromers eingebaut wurde und stellt somit sicher, dass CENP-A tatsächlich nur im zentromeren Chromatin angereichert wird“, erklärt Huang, der die neuen Forschungserkenntnisse bereits beim „ASBMB-BSC Symposium on the interplay between Epigenetic Regulation and Genome Integrity“ in Suzhou. China, vorstellen konnte.
Die im Journal Nucleic Acids Research veröffentlichte Forschungsarbeit entstand in Zusammenarbeit mit Herbert Lindner (Institut für Klinische Biochemie), Fabian Schuler (Institut für Entwicklungsimmunologie), Stephan Geley (Institut für Pathophysiologie) und Doris Wilflingseder (Institut für Hygiene und Medizinische Mikrobiologie).
(2.12.2019, D. Heidegger)
Links:
Phosphorylation of Drosophila CENP-A on serine 20 regulates protein turn-over and centromere-specific loading. Anming Huang, Leopold Kremser, Fabian Schuler, Doris Wilflingseder, Herbert Lindner, Stephan Geley, Alexandra Lusser. Nucleic Acids Research, Volume 47, Issue 20, 18 November 2019, Pages 10754–10770, Published: 19 September 2019
Chromatin- and Epigenetics Laboratory
NEWS-Archiv: Neue Einblicke in den zentralen Prozess der Zellteilung