Neue Rolle des Immunregulators NR2F6 in T Helfer Zellen aufgeklärt
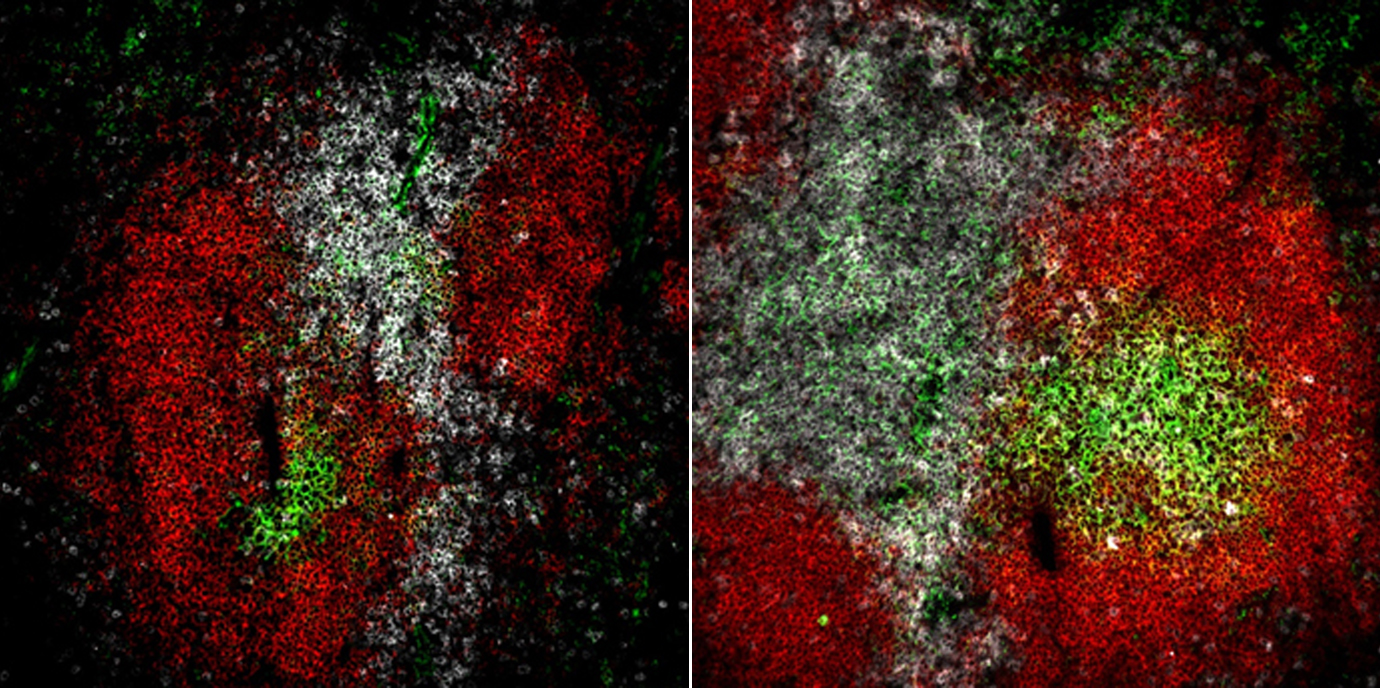
Autoimmunerkrankungen wie der Systemische Lupus erythematodes (SLE) werden durch eine gestörte Immunregulation verursacht. Das Team um Natascha Kleiter vom Institut für Zellgenetik konnte nun einen neuen molekularen Mechanismus des nukleären Kernrezeptors NR2F6 in Immunzellen identifizieren, mit dem sich neue Wege zur gezielteren Immunsuppression erschließen könnten.(Bild: Kleiter/Cell Reports)
Am Innsbrucker Institut für Zellgenetik (Direktor: Gottfried Baier) steht NR2F6 schon seit vielen Jahren im Fokus des Forschungsinteresses. Autoimmunerkrankungen wie der Systemische Lupus erythematodes (SLE) werden durch eine gestörte Immunregulation verursacht. SLE ist im weiteren Verlauf durch eine verstärkte T Helfer Zellaktivierung, eine verstärkte B Zellinduktion und eine vermehrte Antikörpersekretion gekennzeichnet, was letztendlich zu Ablagerungen von Immunkomplexen im Gewebe führt. Die in Schüben verlaufende chronisch entzündliche Erkrankung kann verschiedene Organe wie die Gelenke, das Herz, die Lungen und Nieren sowie das komplette Nervensystem betreffen, bei einem Großteil der PatientInnen kommt es im Verlauf der Erkrankung zu einem Hautbefall, als ein charakteristisches Zeichen gilt das Schmetterlingserythem. Lupus erythematodes ist bisher nicht heilbar. Therapieziel ist es, eine Verschlimmerung der Krankheit und Folgeschäden sowie damit verbundene Einschränkungen möglichst zu verhindern. Neueste, im Fachmagazin Cell Reports veröffentlichte Erkenntnisse aus dem Team um die Zellgenetikerin Natascha Kleiter könnten nun dazu beitragen, neue Immuntherapie-Konzepte zu entwickeln.

BU: v.l.: Bojana Jakic, Verena Labi, William Olson, Natascha Kleiter, Gottfried Baier und Victoria Klepsch.
Natascha Kleiter und ihr Team erforschen die Rolle von nukleären Kernrezeptoren in der Regulierung des erworbenen Immunsystems insbesondere in T Lymphozyten, die der determinierende Faktor für die Krankheitsmanifestation des SLE sind. „Die funktionelle Rolle dieser Rezeptoren ist in verschiedenen Untertypen der CD4 Helfer Zellen bereits sehr genau analysiert worden. Dies trifft allerdings nicht für die follikulären CD4 Helfer Zellen zu, die in der Keimzentrumsreaktion essentiell für die Aktivierung von B Zellen und die Bildung von Antikörpern und somit für die Ausbildung der Gedächtnisfunktion des Immunsystems nach einer Infektion oder Impfung verantwortlich sind“, spricht die Zellgenetikerin Natascha Kleiter einen Bereich an, der im Rahmen von SLE relevant ist, nachdem überschießende Funktionen der follikulären CD4 Helfer Zellen bzw. eine Deregulierung der Expression des nukleären Rezeptors NR2F6 in SLE-PatientInnen bereits beobachtet wurden.
NR2F6 als Handbremse der T Helferzellen
Ziel dieser Arbeit war es nun, den funktionellen und den molekulare Mechanismus von NR2F6 in follikulären CD4 Helfer und Keimzentrums B Zellen im Mausmodell aufzuklären. „Mäuse, denen der Kernrezeptor NR2F6 fehlt, bilden nach Immunisierung eine verstärkte Keimzentrumsreaktion mit erhöhter Zahl an follikulären CD4 Helfer Zellen, B Zellen und Plasma Zellen aus und entwickeln somit im Alter ein Krankheitsbild, das dem humanen SLE gleicht“, erklärt Erstautor und PhD-Student William Olson. In adaptiven Übertragungsexperimenten konnte das Team erstmals im Detail die Zell intrinsiche Rolle von NR2F6 in follikulären T Helfer Zellen untersuchen. Vor allem der pro-entzündliche Botenstoff Interleukin-21 verursacht die Überreaktion der T und B Zellen bei SLE. Nun konnten zum ersten Mal jene Bereiche identifiziert werden, an die NR2F6 in der Promoterregion des IL-21 Gens bindet. „Die Relevanz der erhöhten IL-21 Produktion konnten wir durch die spezifische Blockade des IL-21 Rezeptors in Mäusen ohne NR2F6 nachweisen, da dadurch die Akkumulatoin der T Helferzellen und damit die überschießende Immunreaktion eindrucksvoll verringert wurde“, ergänzt Olson.
Mögliches Therapieziel zur gezielteren Immunsuppression
Mit dem Wissen, dass NR2F6 also gleichsam als molekulare „Handbremse“ der CD4 Helfer Zellen wirkt, kann nun gezielt nach konzeptionell neuen Immuntherapien gesucht werden. „Vor allem der Regulationsmechanismus weiterer nukleärer Rezeptoren, für die es zum Teil auch schon Medikamente gibt, ist für diesen Ansatz von Interesse, um so multifaktorielle Autoimmunerkrankungen wie SLE zu lindern“, so Kleiter.
Dieses Projekt fand im Rahmen des erfolgreiche PhD Programes MCBO und in Zusammenarbeit mit der Sektion für Entwicklungsbiologie am Biozentrum statt und wurde zusätzlich noch durch weitere laufende Projekte von Natascha Hermann-Kleiter und Gottfried Baier unterstützt.
(Text: D. Heidegger, Bilder: Kleiter/Cell Reports, Heidegger)
Links:
Orphan Nuclear Receptor NR2F6 Suppresses T Follicular Helper Cell Accumulation through Regulation of IL-21. Olson WJ, Jakic B, Labi V, Schoeler K, Kind M, Klepsch V, Baier G, Hermann-Kleiter N.Cell Rep. 2019 Sep 10
Institut für Zellgenetik
myPoint-Archiv: Prof. Ernst Brandl-Preis für Zellgenetikerin Natascha Kleiter