Neue Einblicke in die Neurofibromatose Typ1 (NF1)
Neurofibromatose (NF1) ist eine vielschichtige Multiorganerkrankung. Auf Grund ihrer Komplexität gibt die Krankheit ÄrztInnen und WissenschafterInnen noch viele Rätsel auf. Ein Team von ForscherInnen um Dr.in Theresia Dunzendorfer-Matt und den Direktor der Sektion für Biologische Chemie, Univ.-Prof. Dr. Klaus Scheffzek, gibt mit ihrer jüngsten Forschungsarbeit neue funktionelle Einblicke in die biochemischen Grundlagen.
Im deutschsprachigen Raum wird jeden Tag ein Kind mit Neurofibromatose Typ1 (NF1) geboren. 3.000 Menschen sind in Österreich von der Erkrankung betroffen. Wesentlich seltener ist das mit NF1 verwandte Legius Syndrom (LS). Beide Erkrankungen sind in jeder Hinsicht sehr komplex: Die auftretenden klinischen Symptome sind vielfältig und inkludieren bei NF1 Pigmentierungsanomalien der Haut, die namensgebenden Neurofibrome, das sind gut- und bösartige Tumore des Nervensystems, Knochendeformationen oder kognitive Defizite wie Lernstörungen. LS ähnelt der NF1 in den weniger schweren Symptomen. Sowohl NF1 als auch LS sind genetisch bedingte Syndrome: PatientInnen tragen Mutationen im NF1-Gen beziehungsweise im SPRED1 Gen. Diese Gene kodieren die Baupläne für zwei signalregulatorische Proteine (genannt Neurofibromin und Spred1), die beide am gleichen das Zellwachstum regulierenden Signalweg angreifen.
Besseres Verständnis der mechanistischen Grundlagen
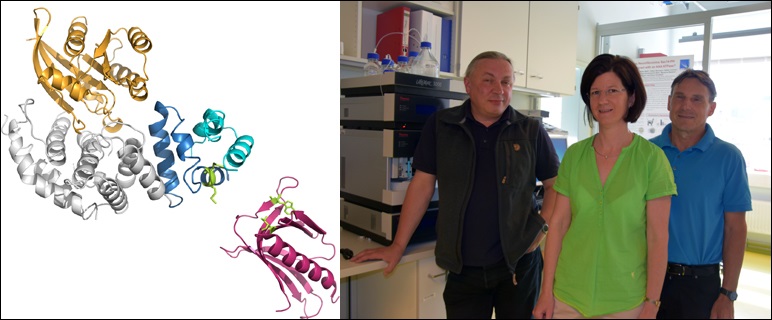
Durch die Analyse der Proteinfunktionen erhoffen sich die WissenschafterInnen ein besseres Verständnis für die Symptome der Erkrankung zu erhalten. „Unsere oberste Frage ist das ´Warum?` Wir wollen dazu beitragen, die relevanten Mechanismen zu erklären“, erklärt Dr.in Theresia Dunzendorfer-Matt. Auf Basis der Grundlagenforschung könnten möglicherweise auch neue Therapien entwickelt werden. Dunzendorfer-Matt ist Proteinchemikerin an der Sektion für Biologische Chemie und Erstautorin des jüngsten Fachartikels zu NF1, der kürzlich in der renommierten Zeitschrift PNAS veröffentlicht wurde. ForscherInnen der Sektion für Biologische Chemie (Direktor: Univ.-Prof. Dr. Klaus Scheffzek) geben in Zusammenarbeit mit der Sektion für Medizinische Biochemie und der Universität von Kalifornien (San Francisco, UCSF) neue Einblicke in die Funktion des komplexen Neurofibromin Proteins. Die Ergebnisse ihres Projektes hat Dunzendorfer-Matt Mitte Juni auch im Rahmen des jährlich stattfindenden Meetings der amerikanischen „Children‘s Tumor Foundation“ in Austin (Texas) präsentiert. Dabei handelt es sich um den weltweit wichtigsten Wissenschaftskongress im Zusammenhang mit der Erforschung und Behandlung von Neurofibromatose.
Relevant für Krebsforschung: NF1 wichtiger Schalter um Krebsgen RAS zu blockieren
Die Innsbrucker Forschungserkenntnisse könnten auch für die Krebsforschung von großem Interesse sein. Die Bindung von Neurofibromin an Spred1 ist für die Blockierung des Ras-Proteins verantwortlich. „In rund 30 Prozent aller bösartigen Tumoren werden Mutationen im RAS-Gen gefunden, die unkontrollierte Aktivität von Ras zur Folge haben. Neurofibromin vermittelt das wirksame Ausschalten von RAS und sein molekularer Bauplan ist selbst in einer Vielzahl hochmaligner sporadischer (d.h. nicht in Bezug zu NF1 stehender) Tumore genetisch verändert“, erklärt Univ.-Prof. Scheffzek. Bei PatientInnen mit Neurofibromatose oder dem Legius-Syndrom ist die Regulation des Ras-Signalweg durch die Mutationen im NF1 oder SPRED1-Gen gestört. Neue Erkenntnisse, wie Neurofibromin im Proteinkomplex mit Spred1 zur Signal-Kontrolle beitragen könnte, bringen jetzt die Ergebnisse der vorliegenden Forschungsarbeit. Vorherige Arbeiten im Labor von F. McCormick haben die Interaktion von Spred1 und Neurofibromin gezeigt, jedoch nicht den Bindungsort von Spred1 am Proteingiganten Neurofibromin angeben können. „Wir haben nun die Bindungsstelle von Spred1 an Neurofibromin definiert und präzisiert und gezeigt, dass sie in enger Nachbarschaft zur der für Ras liegt, ohne jedoch mit der Ras-regulierenden Funktion zu interferieren“, erklärt Dunzendorfer-Matt. In einem nächsten Schritt soll nun die dreidimensionale Struktur der gefundenen Interaktionen näher beleuchtet werden. Derzeit läuft im Umkreis dieser Thematik bereits ein vom FWF gefördertes Projekt an der Sektion für Biologische Chemie der Medizinischen Universität Innsbruck. (P P 28975, Projektleiter: Univ.-Prof. Dr. Scheffzek)
Publikation:
AutorInnen: Theresia Dunzendorfer-Matt, Ellen L. Mercado, Karl Maly, Frank McCormick und Klaus Scheffzek.
(B. Hoffmann-Ammann)
Weiterführende Links:
MyPoint Beitrag: Workshop über Neurofibromatosen
Sektion für Biologische Chemie