Checkpoint Cbl-b: Kontrollpunkt in der Immunantwort eröffnet neue Horizonte in der Krebsimmuntherapie
Neue, im Fachjournal Nature publizierte Erkenntnisse zur Relevanz des Proteins Cbl-b in der Immunantwort bei Krebs bzw. deren klinsich-pharmakologische Verwertung, die mit Unterstützung der Österreichischen Forschungsförderungsgesellschaft als BRIDGE-Projekt über die Bühne gehen wird, geben der Krebs-Immuntherapie neuen Antrieb. Hinter dieser Entwicklung steht – neben internationalen WissenschafterInnen – die Forschungsgruppe um den Innsbrucker Zellgenetiker Univ.-Prof. Dr. Gottfried Baier.
Jüngste Forschungen am Tiermodell schreiben der E3 Ubiquitin-Protein LigaseCbl-b eine Schlüsselrolle in der Hemmung der anti-metastasierenden Funktion von Immunzellen zu. Vor dem Hintergrund, dass die Metastasierung bis heute die größte Herausforderung im Rahmen der Krebstherapie darstellt, bergen diese Erkenntnisse besonderes therapeutisches Potential. „Krebszellen wenden verschiedene Tricks an, um dem Immunsystem zu entkommen und das Protein Cbl-b fungiert dabei als eine Art Checkpoint in der Anti-Tumor-Immunantwort. Der Tumor missbraucht sozusagen die Immunzelle und macht aus einer tumorbekämpfenden Zelle eine tumorernährende Zelle“, erklärt Prof. Baier. Der Direktor der Sektion für Translationale Zellgenetik an der Medizinischen Universität Innsbruck leistet seit Jahrzehnten einen international sichtbaren Beitrag, die molekularen Aktivierungsprozesse einer erworbenen Immunantwort zu entschlüsseln und diese Kenntnis für die translationale Forschung auch zeiteffizient umzusetzen.
Blockade spezifischer Immun-Checkpoints verringert Metastasierung
Unter der Federführung von Univ.-Prof. Dr. Josef Penninger, wissenschaftlicher Direktor am IMBA (Institut für Molekulare Biotechnologie der Österreichischen Akademie der Wissenschaften) in Wien gelang es einer breiten Allianz von internationalen WissenschafterInnen nun, weitere entscheidende Player im Clb-b Signalweg zu identifizieren: die TAM Tyrosin Proteinkinase Rezeptoren TYRO3, AXL und MER. Die selektive pharmakologische Hemmung dieser TAM Rezeptoren durch oral verfügbare niedermolekulare Inhibitoren (small molecule drugs) könnte zur Stärkung des Immunsystems gegen metastasierenden Krebs wirken. Über diesen proof-of-concept (Konzeptnachweis) im Mausmodell berichten die ForscherInnen in der aktuellen Ausgabe von Nature.
Die Blockade von Immun-Checkpoints wie CTLA4 und PD-1/PD-1L hat sich in jüngster Zeit als vielversprechende Strategie in der Entwicklung neuer Krebsimmuntherapien etabliert. Im Unterschied zu diesen Therapieansätzen, die auf Moleküle auf der Zelloberfläche zugreifen, fungiert Cbl-b als intrazellulärer Checkpoint. „Besonders beeindruckend ist dabei die Tatsache“, so Prof. Baier, „dass die Inhibition der Clb-b/TAM-Signalachse dazu führt, dass Immunzellen in verschiedenen klinisch relevanten Mausmodellen von sich aus den Primärtumor sowie auch dessen Metastasen effizient abstoßen.“ Schon in früheren Publikationen konnte seine Arbeitsgruppe nachweisen, dass kurzzeitige therapeutische Clb-b-Hemmung mittels RNA Interferenz in Immunzellen ausreicht, um die Immunantwort gegen Krebs wesentlich zu verbessern.

Grad der Metastasierung ohne Cbl-b-Hemmung
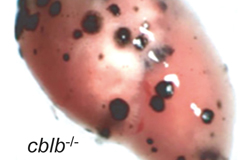
Grad der Metastasierung mit Cbl-b-Hemmung
Neues Potential für die Krebsimmuntherapie
Vor dem Hintergrund des Hypes der Krebsimmuntherapien erweisen sich diese präklinischen Daten als vielversprechend für die Auslösung einer effektiven Immunantwort zur Tumorabstoßung durch das patienteneigene Immunsystem. Nachdem der Cbl-b Signalweg nun ein hervorragend validiertes Target in der Immuntherapie darstellt, wurde ein gezieltes Programm zur klinischen Entwicklung einer small molecule drug eingeleitet, das als adjuvante Therapie das Immunsystem der PatientInnen selektiv zur Tumorabwehr befähigt. Im Rahmen des „Brückenschlagprogramms” (BRIDGE) der Österreichischen Forschungsförderungsgesellschaft (FFG) finden sich nun nach einer hochkompetitiven Ausschreibung die Medizinische Universität Innsbruck für die Grundlagenforschung, das Universitätsklinikum Bonn für die Klinische Relevanz und ApeironBiologics für die Anwendung und Verwertung als geförderte Partner wieder (Projekttitel: “Boosting anti-tumor immunity: Blocking Cbl-b immune-inhibitory signaling pathways as a unique cancer therapeutic target). Für die Entwicklung dieser völlig neuartigen Klasse von immuntherapeutischen Krebsmedikamenten werden im Rahmen dieses FFG BRIDGE Projekts immunologische Grundlagen- und Arzneimittelforschung sowie Erkenntnisse aus der Klinik synergetisch verbunden.
BRIDGE wurde im Jahr 2004 als gemeinsame Initiative von FFG und FWF zur Förderung von Projekten an der Schnittstelle zwischen wissenschaftlicher Grundlagenforschung an Instituten und experimenteller Entwicklung in den Unternehmen etabliert.
(D.Heidegger)
Links:
The E3 Ligase Cbl-b and TAM receptors regulate cancer metastasis by inhibiting natural killer cell activity. Magdalena Paolino, Axel Choidas, Stephanie Wallner, Blanka Pranjic, Iris Uribesalgo, Stefanie Loeser, Amanda M. Jamieson, Wallace Y. Langdon, Fumiyo Ikeda, Juan Pablo Fededa, Shane J. Cronin, Roberto Nitsch, Carsten Schultz-Fademrecht, Jan Eickhoff, Sascha Menninger, Anke Unger, Robert Torka, Thomas Gruber, Reinhard Hinterleitner, Gottfried Baier, Dominik Wolf, Axel Ullrich, Bert M. Klebl & Josef M. Penninger
Nature, Published online 19 Feb 2014.
http://www.nature.com/nature/journal/vaop/ncurrent/full/nature12998.html?WT.ec_id=NATURE-20140220
BRIDGE Programm der FFG
https://www.ffg.at/bridge-fruehphase
Sektion für Translationale Zellgenetik
http://www.sfb021.at/baier/
Universitätsklinikum Bonn, Innere Medizin III
http://www.ukb.uni-bonn.de/42256BC8002AF3E7/vwWebPagesByID/A17E8F2AA640820FC125793C00559987
APEIRON Biologics AG
http://www.apeiron-biologics.com/




