Überraschende Einblicke in die komplexen Prozesse der inneren Logistik von menschlichen Zellen
Eine nationale Forschungskooperation unter der Leitung von Lukas A. Huber und Mariana Eca Guimaraes Araujo von der Medizin Uni Innsbruck sowie David Haselbach und Tim Clausen vom Forschungsinstitut für Molekulare Pathologie (IMP) bringt neue Einblicke in die innere Logistik von Zellen. Die Erkenntnisse zeigen, dass zwei zentrale Protein-Komplexe, BLOC-1 und BORC, nicht unabhängig voneinander funktionieren, wie bisher angenommen.
Die Forschungsergebnisse eröffnen neue Perspektiven für therapeutische Ansätze bei entwicklungsbedingten neurologischen Störungen und verschiedenen Krebsarten. Die Struktur und Funktion von sogenannten eukaryotischen Zellen basieren auf hochkomplexen Prozessen der inneren Logistik, bei der Proteine, Membranen und andere Bestandteile gezielt an ihren Bestimmungsort transportiert werden. Zwei zentrale und evolutionär hoch konservierte Protein-Komplexe, BLOC-1 (Biogenesis of Lysosome-Related Organelles Complex-1) und BORC (BLOC-1 related complex), spielen hierbei eine maßgebliche Rolle. Sie steuern sowohl den Transport von Molekülen in spezifische Zellabschnitte und sind auch für die Positionierung von Lysosomen verantwortlich, das sind die Recycling- und Signaltransduktionszentren der Zelle.
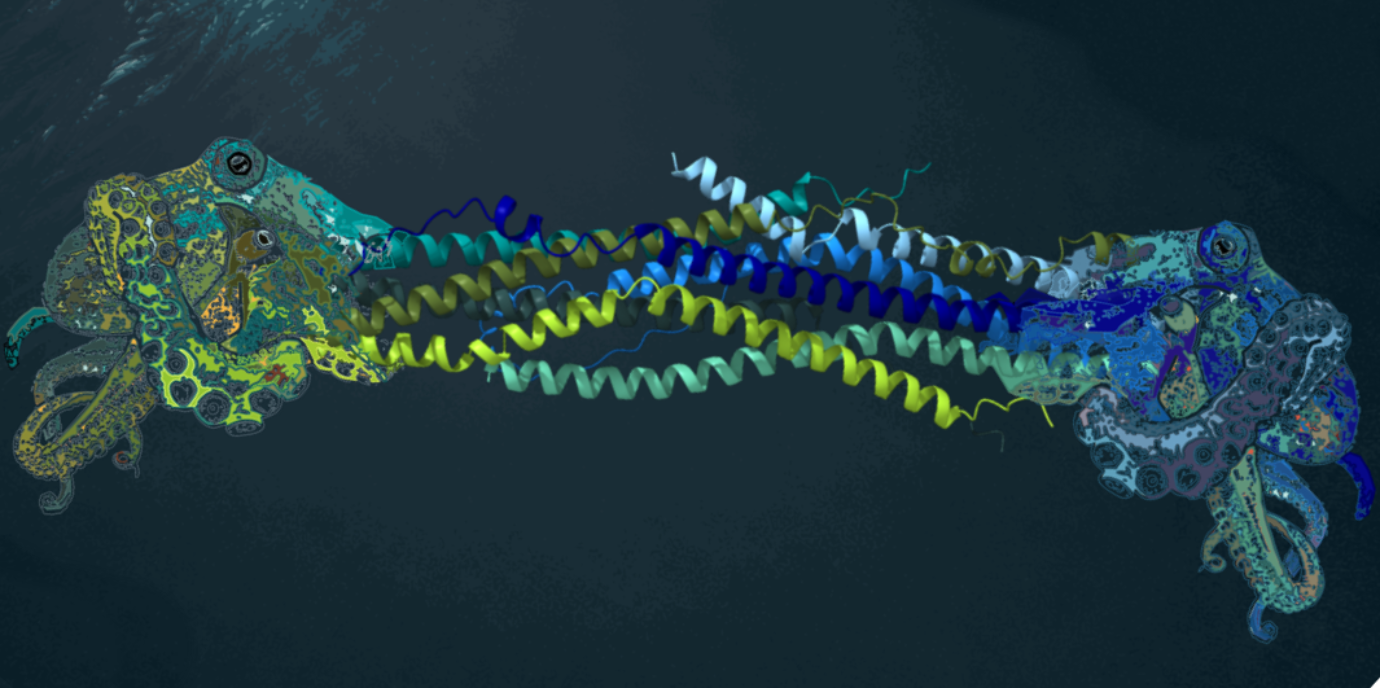
Lukas A. Huber, Direktor des Instituts für Zellbiologie, und seine Kolleg:innen Mariana Eca Guimaraes Araujo und Taras Stasyk sowie Sascha Amann, David Haselbach und Tim Clausen vom Forschungsinstitut für Molekulare Pathologie (IMP) haben nun ganz neue Erkenntnisse über diese Komplexe publiziert. Mithilfe einer Kombination aus Kryo-Elektronenmikroskopie, Crosslinking-Massenspektrometrie und biochemischen Analysen gelang dem Team ein tiefer Einblick in Struktur und Funktionsweise von BLOC-1 und BORC. Die Studie, die im renommierten Fachjournal PNAS (Proceedings of the National Academy of Sciences) veröffentlicht wurde, zeigt erstmals, dass BLOC-1 und BORC nicht als feste, unveränderliche Einheiten existieren, sondern vielmehr als flexible Familien von verwandten Komplexen bestehen. Frühere Vorstellungen, wonach es sich um starre, einheitliche Einheiten handelt, werden damit grundlegend infrage gestellt.

1. Reihe vorne: Mariana Araujo, 2. Reihe von Links: Eva Rauch, Thanida Laopanupong, Paula Flümann, 3. Reihe von Links: Taras Stasyk, Caroline Krebiehl, Isabel Singer, Leopold Kremser, Bettina Sarg, 4. Reihe von links: Samuel Kofler, Georg F. Vogel, Nikolaus Obojes, Flora S. Gradl, Lukas A. Huber. (Foto: MUI/D. Bullock)
Neue Perspektiven auf die zelluläre Logistik
Die Forscher:innen klärten die atomare Struktur des oktameren BORC-Komplexes auf und basierend auf biochemischen und strukturellen Analysen identifizierten sie verschiedene Varianten der BLOC-1- und BORC-Komplexe, die sich durch unterschiedliche Kombinationen und die Anzahl von Untereinheiten auszeichnen. Einige dieser Varianten bilden klassische BLOC-1- oder BORC-Strukturen, während andere Mischkomplexe sind, die Elemente beider Systeme kombinieren. Die Studie zeigt, wie die Bildung und Aktivität von BORC durch spezifische Signale, darunter die Phosphorylierung der Untereinheit Snapin und ein pH-empfindlicher Histidin-Rest (BORCS5-H99), gesteuert wird. Zudem erklären die Daten, wie krankheitsverursachende Mutationen den Komplex destabilisieren. Die entscheidende Entdeckung war, dass nicht alle Komponenten der Komplexe gleichzeitig vorhanden sein müssen. Stattdessen können Zellen die Module flexibel zusammensetzen, um jeweils spezialisierte Transportsysteme zu bilden, die ihren aktuellen Bedürfnissen entsprechen.
Lukas A. Huber, einer der korrespondierenden Autoren und Leiter der Forschungsgruppe an der Medizin Uni Innsbruck, erklärt: „Unsere Arbeit stellt das alte Paradigma in Frage und etabliert ein neues Modell dynamischer Komplexbildung. Die Zelle nutzt diese modularen Bausteine wie ein Baukastensystem, um ihre zelluläre Logistik an verschiedene Bedürfnisse anzupassen.“
Bedeutung für Medizin und Therapie
Die neuen Erkenntnisse über die Struktur und Funktion der BLOC-1- und BORC-Komplexe haben weitreichende Implikationen. Fehler in diesen Komplexen sind mit entwicklungsbedingten Störungen, Pigmentierungsfehlern und verschiedenen Krebsarten verbunden. Dieses neue Verständnis hat unmittelbare Konsequenzen für die Erforschung damit assoziierter Krankheiten. „Die genaue Unterscheidung zwischen den kanonischen Komplexen und den verschiedenen Hybrid-Assemblies ist eine wesentliche Voraussetzung für künftige Therapien“, betont Mariana Eca Guimaraes Araujo von der Medizin Uni Innsbruck und führende Erstautorin der Studie. „Wir müssen verstehen, welche spezifische Assemblie in einem Krankheitskontext fehlreguliert ist. Die Wirksamkeit und Spezifität pharmakologischer Interventionen hängen davon ab, ob wir den richtigen Komplex adressieren können.“
Dieser Durchbruch könnte somit den Weg zu neuen therapeutischen Ansätzen ebnen, die auf die jeweils relevanten Komplexvarianten abzielen und dabei individuelle Krankheitsbilder berücksichtigen. Die Zusammenarbeit zwischen Strukturbiologie und Zellbiologie sowie der Einsatz modernster Technologien, wie Kryo-Elektronenmikroskopie und Massenspektrometrie, waren dabei essenziell.
Mit diesen Einsichten bietet die Studie eine solide Grundlage für weitere Forschung und legt den Fokus auf die dynamische Modularität der zellulären Logistiksysteme – ein Meilenstein, der nicht nur das Verständnis der Zellbiologie vertieft, sondern auch neue Horizonte für die biomedizinische Forschung eröffnet.
Link zum Paper:
BORC assemblies integrate BLOC-1 subunits to diversify endosomal trafficking functions
https://www.pnas.org/doi/10.1073/pnas.2515691123
(22.01.2026, Text: RED/HOF, Grafik: Isabel Singer, Foto: MUI/D. Bullock)
Weitere Informationen: