Neuartiger Mechanismus der Virusreplikation entdeckt
Aus Studien zur Entstehung neuer Gene wird klar: Die Evolution ermöglicht durch die Duplikation von Genen und deren anschließender Mutation, dass neue Gene aus bereits vorhandenen Genen entstehen können. Auch durch die sogenannte „Exaptation“ werden bestimmte Gene, die im Laufe der Zeit bereits erfolgreich für bestimmte Funktionen verwendet wurden, für andere, unterschiedliche Funktionen adaptiert, ein Beispiel dafür sind transfer RNAs (tRNAs).
In der Proteinsynthese spielen tRNAs, kleine, ca. 70-90 Nukleotid lange, nicht-kodierende RNAs eine zentrale Rolle. Abhängig von einer bestimmten Boten RNA (mRNA), bringen sie Aminosäuren ans Ribosom, die dann durch eine Peptidbindung verknüpft werden und dabei Proteine ausbilden. Diese Interaktion von tRNAs (inklusive ihrer Modifikationen) mit den entsprechenden sogenannten Codons innerhalb einer mRNA am Ribosom ist in allen Organismen hochkonserviert und bildet das zentrale Forschungsgebiet von Matthias Erlacher (siehe dazu den kürzlich erschienen Review im Journal of Molecular Biology) am Institut für Genomik und RNomik (Direktor Andreas Mayer).
tRNAs können auch anderweitig für molekularbiologische Funktionen eingesetzt, d.h. exaptiert werden, wie die Arbeitsgruppe von Alexander Hüttenhofer (ehemaliger Leiter des Instituts für Genomik und RNomik) zusammen mit seinem Doktoranden Simon Hoser bereits zeigen konnte (siehe myPoint-Artikel „Erstmalig beschrieben: Was macht mitochondriale DNA im Zellkern?“)
Auch von anderen Arbeitsgruppen wurden Exaptationen von tRNAs beobachtet, wie z.B. bei der Integration des HIV Genoms in menschliche Zellen: Dabei wird wiederum eine tRNA benötigt, die als Primer für die reverse Transkription des HIV RNA Genoms in DNA dient und damit die Integration und Vermehrung des Virus erst ermöglicht. Somit sind also tRNAs sowohl in der Proteinsynthese, beim Splicing und bei der reversen Transkription von Viren beteiligt – alles grundlegende und fundamentale Prozesse in humanen und anderen eukaryontischen Zellen.
Eine kürzlich im renommierten Journal Nature Structural & Molecular Biology erschienene Arbeit von Utz Fischer und seiner Arbeitsgruppe von der Universität Würzburg und unter der Mitwirkung von Matthias Erlacher und Alexander Hüttenhofer zeigt nun ein weiteres Beispiel für die Exaptation von tRNAs während der Evolution auf. „Wir konnten nachweisen, dass ein bestimmtes tRNA Molekül als Assembly-Chaperon* für die Bildung der viralen RNA-Polymerase (vRNAP) fungiert. Diese Entdeckung stellt das erste bekannte Beispiel dar, bei dem ein Chaperon nicht aus einem Protein, sondern aus einer Nukleinsäure besteht und liefert neue Einblicke in die virale Genexpression und damit potenzielle Ansatzpunkte für die Entwicklung antiviraler Wirkstoffe“, so Matthias Erlacher. Im Rahmen einer umfassenden Analyse von Pockenviren identifizierte das Würzburger Forschungsteam zusammen mit Matthias Erlacher und Alexander Hüttenhofer einen neuartigen Typ dieser Chaperone. Bemerkenswerterweise besteht dieser nicht aus einem Protein, sondern aus RNA – konkret aus einer tRNA. Diese Entdeckung repräsentiert ein bisher unbekanntes Prinzip molekularer Selbstorganisation viraler Komponenten.
Struktur und Funktion der viralen RNA-Polymerase
Im Zentrum der Untersuchung stand die komplette virale RNA-Polymerase (vRNAP) des Vaccinia-Virus, des Prototyps der Pockenviren. Dieses Enzym besteht aus 15 Proteinuntereinheiten und einer RNA-Komponente und spielt eine zentrale Rolle bei der Genexpression, d. h. bei der Transkription viraler Gene.
„Die vRNAP wirkt als integrierte molekulare Einheit“, erläutert Erstautorin Julia Bartuli von der Universität Würzburg, Erstautorin der Studie, die die biochemischen Untersuchungen leitete. Um zu verstehen, wie sich dieser komplexe Verbund präzise zusammenfügt, kombinierten die Forschenden biochemische und strukturbiologische Methoden, um die Assembly-Schritte im Detail zu rekonstruieren.
tRNA als strukturelles Assembly-Chaperon
Die Ergebnisse zeigen, dass die vRNAP durch ein Chaperon zusammengefügt wird, das kein Protein repräsentiert. Dieses Chaperon besteht vielmehr aus einer spezifischen tRNA, die während des Assemblierungsprozesses reversible strukturelle Konformationen einnimmt. RNA ist in der Regel nicht an solchen Prozessen beteiligt; in diesem Fall jedoch sitzt die tRNA jedoch zentral zwischen der Polymerase und assoziierten Faktoren und stabilisiert die Interaktionen, die für die korrekte Bildung des Komplexes erforderlich sind.
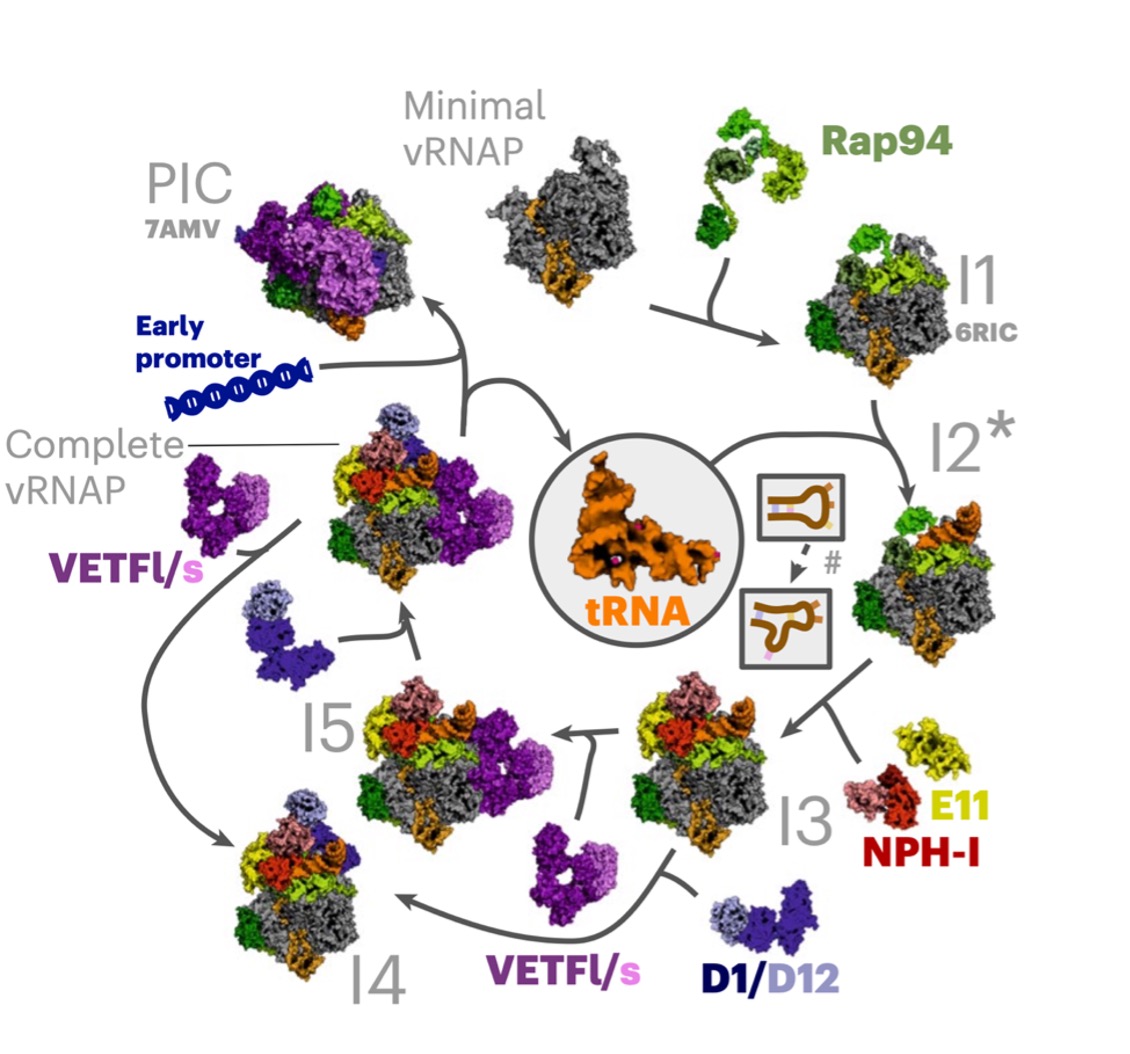
BU: Assembly der viralen RNA Polymerase von Pockenviren, die durch eine tRNA (in orange) als Chaperon erst ermöglicht wird (Bartuli et al., 2025, Nat. Struct. & Mol. Biology).
Fehlt die tRNA, zeigen die Komponenten keine Affinität zueinander und können sich nicht selbstständig organisieren. Nur durch die dynamische Umlagerung der tRNA kommt es zu einer korrekten sequentiellen Anordnung und Stabilisierung des Komplexes. Daher sind tRNAs also nicht nur bei der Translation und dem Splicing von mRNAs sondern auch bei deren Transkription beteiligt, die drei grundlegendsten Mechanismen in der molekularen Biologie. Die Erkenntnisse haben unmittelbare Relevanz für aktuelle Entwicklungen. Seit mehreren Jahren treten Mpox-Viren (vormals „Affenpocken“) in verschiedenen afrikanischen Regionen vermehrt auf. Diese eng verwandten Orthopoxviren zeigen eine zunehmende genetische Variabilität und potenzielle Veränderungen in den Übertragungswegen.
Die klassische Pockenkrankheit, verursacht durch das Variola-Virus, gehörte über Jahrhunderte zu den tödlichsten Infektionskrankheiten überhaupt. Nach ihrer Ausrottung 1980 endeten die Impfkampagnen – damit besteht heute keine Immunität mehr in der Bevölkerung. Ein mutiertes Mpox-Virus könnte somit auf weitgehend ungeschützte Populationen treffen. Angesichts der vergleichsweise hohen Letalität – insbesondere bei Kindern und Schwangeren – wäre eine schnelle Entwicklung antiviraler Medikamente dringend erforderlich. „Die Ergebnisse der vorliegenden Studie bieten hierfür eine wertvolle Grundlage. Der identifizierte Komplex enthält zahlreiche potenzielle Bindungsstellen für Inhibitoren und eignet sich hervorragend für Drug-Screening-Verfahren“, schließt Alexander Hüttenhofer.
*) Chaperone übernehmen in der Biochemie essenzielle Schutz- und Faltungsfunktionen. Sie unterstützen neu synthetisierte Polypeptide bei der korrekten Faltung und verhindern die Aggregation fehlgefalteter Proteine. Eine spezielle Untergruppe, die sogenannten Assembly-Chaperone, vermittelt die geordnete Zusammenlagerung multipler Proteine zu größeren, funktionellen Komplexen.
(07.01.2026, Text: Hüttenhofer / Heidegger, Bilder: Hüttenhofer, Fischer / Bartuli et al. 2025)
Links:
tRNA as an assembly chaperone for a macromolecular transcription-processing complex. Bartuli et al., 2025, Nat. Struct. & Mol. Biology
Studying the Function of tRNA Modifications: Experimental Challenges and Opportunities. Kompatscher M, Gonnella I, Erlacher M. J Mol Biol. 2025 Aug 15
Intronic tRNAs of mitochondrial origin regulate constitutive and alternative splicing. Hoser et al., 2020, Genome Biology




