Wie Zellen „aufhören zu essen“ und wie das mit einer neuen seltenen Erkrankung zusammenhängt
Ein interdisziplinäres Team aus Grundlagenforscher:innen und Kliniker:innen konnte in enger Zusammenarbeit unter der Leitung von David Teis (Direktor, Institut für Molekulare Biochemie) zeigen, dass das Protein TXNIP eine zentrale Rolle als Schaltermolekül für die Nährstoffaufnahme in Zellen spielt und sein Fehlen mit einer bisher unbekannten, seltenen Stoffwechselerkrankung verknüpft ist – ein gelungenes Beispiel dafür, wie Grundlagenforschung und Medizin ineinandergreifen.
Mit ihrer Entdeckung wirft das Team um die Erstautor:innen Jenny Kahlhofer (inzwischen Zierler) und Nikolas Marchet neues Licht darauf, wie Zellen „aufhören zu essen“, um ihren Stoffwechsel während der Ruhephase (Quieszenz) zu bremsen.
Die kürzlich in The EMBO Journal veröffentlichte Studie zeigt im Detail, dass das α-Arrestin TXNIP (Thioredoxin-Interacting Protein) HECT-Typ-Ubiquitin-Ligasen an den essenziellen Aminosäuretransporter LAT1/SLC7A5 rekrutiert und dadurch dessen Endozytose und lysosomalen Abbau auslöst. Dieser Mechanismus wird aktiviert, wenn Zellen aufhören zu wachsen und stimmt die Aminosäureaufnahme präzise auf die reduzierten metabolischen Anforderungen ruhender Zellen ab. Fehlt TXNIP, gerät dieses Gleichgewicht aus dem Lot: Ruhende Zellen importieren weiterhin Aminosäuren, können ihren Stoffwechsel nicht drosseln und sterben schließlich daran. Interessanterweise war TXNIP bereits zuvor als Regulator der Glukoseaufnahme bekannt – jedoch in einem anderen zellulären Kontext. „Zusammen verdeutlichen diese Ergebnisse die zentrale Rolle von TXNIP als Schaltermolekül für die Nährstoffaufnahme von Zellen. Ähnliche Mechanismen dürften auch in anderen Formen zellulärer Ruhe wichtig sein, etwa in der Stammzellbiologie, Immunregulation, Geweberegeneration oder Krebsentstehung“, betont David Teis.

BU: Die Erstautor:innen Jenny Kahlhofer (inzwischen Zierler) und Nikolas Marchet Fotos: privat
Von der Hefe zur Krankheit
Den Weg zu dieser weitreichenden Erkenntnis ebneten Untersuchungen im Modellorganismus Bäcker-Hefe. Auch die Arbeitsgruppe um David Teis konnte mithilfe dieses Modellorganismus in den vergangenen zehn Jahren erste entscheidende Hinweise darauf liefern, dass Aminosäuretransporter durch α-Arrestin–Ubiquitin-Ligase-Komplexe gezielt abgebaut werden, um das Überleben ruhender Zellen zu sichern (siehe u.a. NEWS-Beitrag „Reduce, reuse, recycle“ ).
„Unsere aktuellen Ergebnisse zeigen darüber hinaus, dass dieses Prinzip auch in menschlichen Zellen konserviert ist, wir konnten diesen Mechanismus sogar in einen bemerkenswerten klinischen Zusammenhang stellen“, so Teis. Das Forschungsteam identifizierte nämlich eine neue, biallelische Verlustfunktion-Mutation im α-Arrestin TXNIP bei einem an der Universitätsklinik für Pädiatrie I (Direktor Thomas Müller) von Daniela Karall und Sabine Scholl-Bürgi behandelten Jungen mit schwerer Stoffwechselentgleisung, die sich durch neonatale Laktatazidose, wiederkehrende Hypoglykämien, Störungen im Aminosäurespiegel im Blut, und Entwicklungsverzögerung äußerte. Der bislang unbekannten, seltenen erblichen Stoffwechselerkrankung konnte so ein grundlegender Mechanismus der Nährstoffregulation zugrunde gelegt werden.
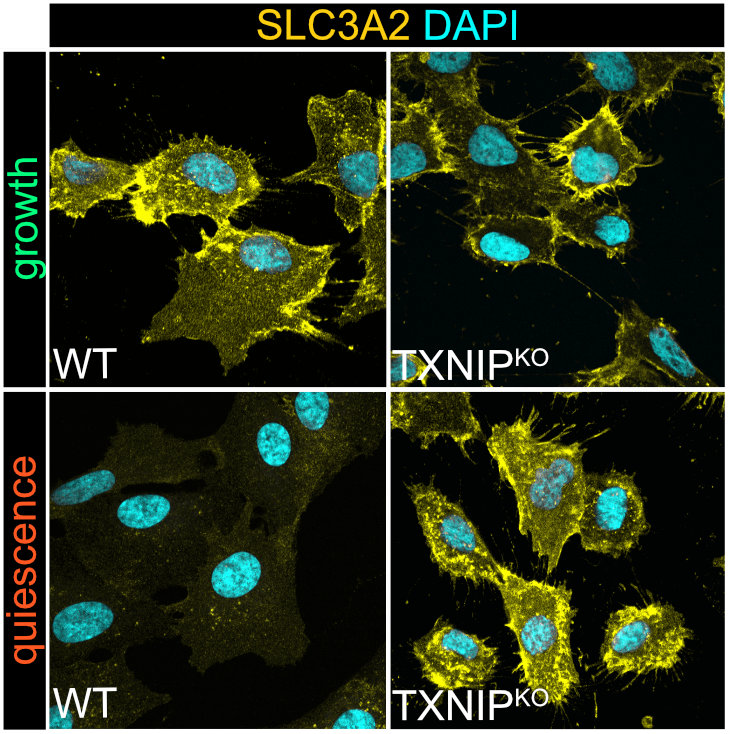
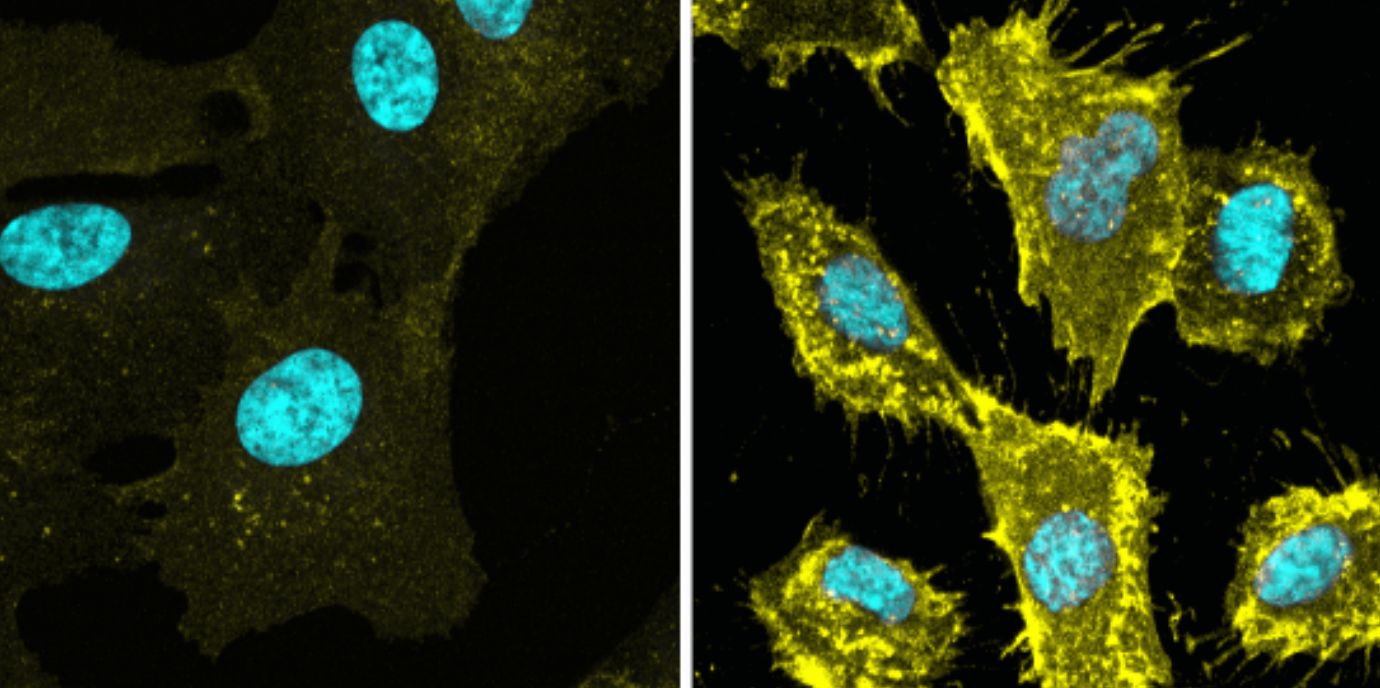
BU: Fluoreszenz Bilder von nicht-cancerogenen diploiden humane Zellen (WT oder TXNIP defizient), die wachsen oder in Quiescenz (Ruhezustand) sind. In Gelb sieht man den Aminosäuretransporter, in Blau die DNA des Zellkerns. © EMBO Journal
Integrative biomedizinische Forschung
Durch die Identifizierung von TXNIP als zentralem Regulator der Aminosäureaufnahme und die Verknüpfung mit einer neu beschriebenen angeborenen Stoffwechselstörung demonstriert die Arbeit, wie die enge Zusammenarbeit zwischen Forschungsinstituten am Biozentrum und klinischen Instituten das molekulare Verständnis von Krankheiten voranbringen. Daniela Karall und Sabine Schöll-Bürgi (Univ.-Klinik für Pädiatrie I) brachten ihre klinische Expertise ein und koordinierten Patientendiagnostik, Stoffwechselanalysen und genetische Untersuchungen, die die krankheitsverursachende TXNIP-Variante bestätigten. Susanne Kaser und Bernhard Radlinger (Univ.-Klinik für Innere Medizin I) führten zentrale Analysen des Glukosestoffwechsels durch, Johannes Zschocke (Direktor Institut für Humangenetik) stellte die vom jungen Patienten abgeleiteten Fibroblasten zur Verfügung. „Die Studie zeigt beispielhaft die interdisziplinäre Stärke der Medizinischen Universität Innsbruck, grundlegende molekulare Mechanismen mit klinischen Krankheitsbildern zu verbinden. Sie macht deutlich, wie Translation in der Medizin funktionieren kann – eben weil das konkrete Ergebnis nicht das ursprüngliche Ziel der explorativen Forschungsarbeiten in Hefe war“, so Teis. In einem bereits geplanten Folgeprojekt interessieren sich die Forscher:innen nun, was mit Zellen passiert, die in Ruhephasen nicht hungern, sondern weiterfressen.
Das Projekt wurde durch das von David Teis koordinierte FWF-Doktoratskolleg „Cellular Basis of Diseases – Molecular Control of Metabolism and Inflammation“ (DOC 82) unterstützt, das durch Tandem-Betreuung gezielt die Zusammenarbeit zwischen Grundlagen-Forschung und Klinik gefördert hat. Zusätzliche Unterstützung kam von der FWF-Forschungsgruppe „Organelle Proteostasis in Cellular Quiescence and Growth“ (FG 5513-B) unter der Leitung von Hesso Farhan, die Core Facilities BioOptics (Martin Offterdinger) und Proteinanalytik (Bettina Sarg) lieferten wichtige methodische Beiträge und technische Unterstützung.
(04.12.2025, Text: Teis/Heidegger, Bilder: EMBO Journal/privat)
Links:
TXNIP mediates LAT1/SLC7A5 endocytosis to limit amino acid uptake in cells entering quiescence, Kahlhofer J. et al., EMBO J. 2025 Oct 20
https://doi.org/10.1038/s44318-025-00608-9
Complementary α-arrestin-ubiquitin ligase complexes control nutrient transporter endocytosis in response to amino acids. Ivashov V. et al., Elife. 2020 Aug 3
https://doi.org/10.7554/eLife.58246
The coordinated action of the MVB pathway and autophagy ensures cell survival during starvation. Müller M. et al., Elife. 2015 Apr 22
https://doi.org/10.7554/eLife.07736
Institut für Molekulare Biochemie
PhD Program Cellular Basis of Diseases (CBD)