A20-Protein hilft, akuten Schub und Remission bei MOGAD zu unterscheiden
Ein internationales Forschungsteam um Erstautor Christian Lechner von der Univ.-Klinik für Pädiatrie I der Medizinischen Universität Innsbruck hat die Rolle des Proteins A20 als potentiellen Prognosemarker für MOGAD untersucht. Dabei stellten die Wissenschafter:innen fest, dass die jeweilige A20-Konzentration Rückschlüsse auf die Krankheitsphase bei dieser Erkrankung des Zentralnervensystems ermöglicht.
Mit der kürzlich im Fachjournal Neuroimmunology & Neuroinflammation (Neurology-Gruppe) veröffentlichten Forschungsarbeit A20 (TNFAIP3) Distinguishes Attack From Remission in Pediatric Patients With Monopahasic MOGAD eines Forschungsteams rund um den Neuropädiater Christian Lechner (Erstautor) von der Univ.-Klinik für Pädiatrie I (Direktor: Thomas Müller) und Seniorautorin Tanuja Chitnis (Harvard Medical School, Boston) wird die Bedeutung Innsbrucks als Forschungsstandort im Bereich der entzündlichen Erkrankungen des Zentralnervensystems einmal mehr hervorgehoben: Das internationale Team hat sich auf die Suche nach Faktoren begeben, die eine Prognose des Krankheitsverlaufs bei MOGAD* (Myelin Oligodendrocyte Glycoprotein Antibody-associated Disorders) erlauben könnten.
In Österreich leben derzeit rund 100 Patient:innen mit einer MOGAD-Diagnose, ein Drittel davon sind Kinder, die ebenso von wiederkehrenden Krankheitsschüben betroffen sein können. Für die vorliegende Untersuchung wurden 162 Serumproben von 62 mit MOGAD diagnostizierten Kindern analysiert. Zusätzlich zogen Lechner und seine Kolleg:innen weitere 46 Proben von 37 pädiatrischen Patient:innen mit anderen neurologischen Erkrankungen heran, wie z.B. MS oder NMOSD.
Mit dem Protein A20 (i.e. TNFAIP3) identifizierten die Forscher:innen nun einen Biomarker-Kandidaten, der bei Patient:innen mit monophasischer MOGAD in der akuten Phase, also im klinisch-relevanten Event signifikant niedriger war, als in Remission. Bei Patient:innen mit multiphasischem Verlauf konnte hingegen kein deutlicher Unterschied der A20-Konzentration während des Schubs und in Remission festgestellt werden.
„TNF ist ein proinflammatorisches Zytokin. A20 blockiert die intrazelluläre Signalwirkung von TNF und wirkt damit entzündungshemmend. Vereinfacht ausgedrückt: Eine hohe TNF-Konzentration führt zur Hochregulation von A20, das die TNF-vermittelte Entzündungsreaktion dämpft; nach Abklingen der Entzündung wird A20 wieder herunterreguliert“, erklärt Lechner, wie die niedrigen A20 Werte zustande kommen. Zudem zeigte sich, dass A20-Werte bei Patient:innen unter Steroid-Therapie tendenziell erhöht waren. TNF⍺-Blocker spielen bei MOGAD keine Rolle, weil es bereits wirkungsvolle Therapien gibt, so der Experte.
Die Hypothese, anhand von A20 bereits zu Krankheitsbeginn vorhersagen zu können, ob es sich um einen monophasische (einmaliges akutes Event) oder multiphasischen (schubhaften, wiederkehrenden) Krankheitsverlauf handeln wird, konnte bisher allerdings nicht bestätigt werden. „In Remission konnten wir keine signifikanten Unterschiede des A20-Levels zwischen monophasischen und multiphasischen Krankheitsverläufen feststellen“, erklärt Lechner.
Aus dem Spiel ist A20 damit nicht. Das internationale Team unter der Leitung von Tanuja Chitnis von der Harvard Medical School in Boston, in deren Labor Lechner 2018/19 forschte, hat als erste Gruppe das Zusammenspiel der Parameter A20 und MOG-Antikörper beschrieben. In Kooperation mit einer europäischen Arbeitsgruppe planen die Forscher:innen nun eine weitere, größere Studie aufzusetzen, um mehr Daten über A20 zu gewinnen.
Auf den ersten Blick ist MOGAD schwer von ähnlichen Krankheiten, wie z.B. Multiple Sklerose oder NMOSD (Neuromyelitis Optica Spektrum-Erkrankungen) zu unterscheiden. Allerdings wurden 2004 krankheitsspezifische Antikörper gegen Aquaporin-4 bei NMOSD-Patient:innen entdeckt, wie Christian Lechner schildert.
Kevin Rostásy, früher Leiter der Neuropädiatrie in Innsbruck, und Markus Reindl, der das Neurologische Forschungslabor an der Univ.-Klinik für Neurologie leitet, haben 2009 in Innsbruck die multizentrische BIOMARKER-Studie zur Evaluierung von Antikörpern bei entzündlichen ZNS-Erkrankungen im Kindesalter initiiert sowie einen lebendzellbasierten Assay zur Testung auf MOG-Antikörper (MOG-lgG) etabliert. Im Rahmen dieser Studie wurde bereits bei über 1000 Kindern und Jugendlichen, zugewiesen aus über 60 vor allem europäischen Zentren, nach MOG- und AQP4-Antikörpern gesucht. Seit 2014 wird die BIOMARKER-Studie von Matthias Baumann als aktuellen Leiter der Neuropädiatrie geleitet. Konsentierte Diagnosekriterien zu pädiatrischer MOGAD wurden erstmalig im November 2020 von einer europäischen Arbeitsgruppe, mit Beteiligung von Lechner, publiziert (Bruijstens et al. 2020). Anfang 2023 sind zudem Diagnosekriterien für MOGAD, die mit maßgeblicher Mitwirkung von Markus Reindl ausgearbeitet wurden, hochrangig in The Lancet Neurology publiziert worden (Artikel "Diagnosekriterien für seltene neurologische Autoimmunerkrankung MOGAD definiert" auf i-med.ac.at). Baumann, Rostásy und Reindl sind auch an der nun vorliegenden aktuellen Forschungsarbeit beteiligt.
Forschungsarbeit: Lechner C, Saxena S, Lokhande HA, Breu M, Eisenkölbl A, Karenfort M, Klein A, Leiz S, Preisel M, Rooney T, Rosso M, Schimmel M, Wendel EM, Reindl M, Baumann M, Rostasy K, Chitnis T. A20 (TNFAIP3) Distinguishes Attack From Remission in Pediatric Patients With Monophasic MOGAD. Neurol Neuroimmunol Neuroinflamm. 2025 Sep;12(5):e200452. doi: 10.1212/NXI.0000000000200452. Epub 2025 Aug 18. PMID: 40825157; PMCID: PMC12363411. https://doi.org/10.1212/NXI.0000000000200452
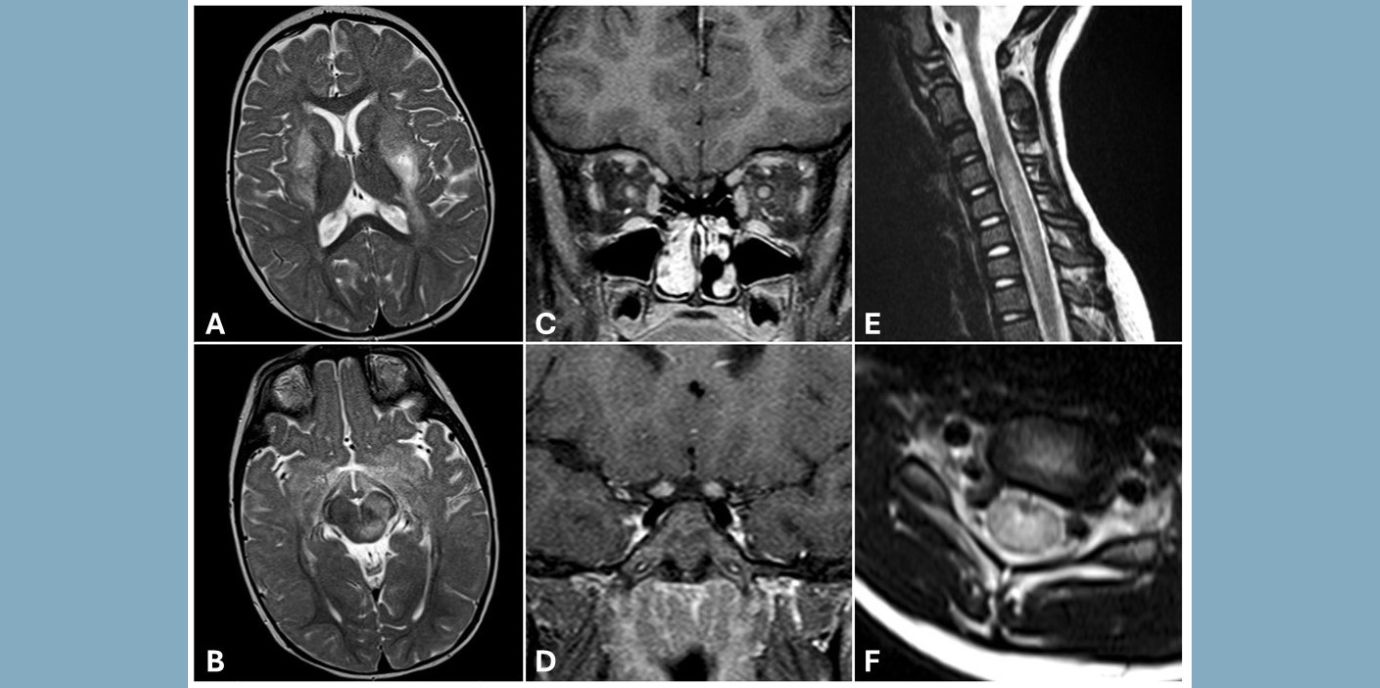
*MOGAD (Myelin Oligodendrocyte Glycoprotein Antibody-associated Disorders) sind entzündliche Erkrankungen des Zentralnervensystems mit unterschiedlichen Ausprägungen bzw. Subtypen. Bei Kindern dominiert meist ADEM (Acute Disseminated Encephalomyelitis), das von einer Enzephalopathie (Bewusstseinsstörung), häufig gepaart mit Koordinations- und motorischen Schwierigkeiten, Übelkeit und Kopfschmerzen charakterisiert ist, während Jugendliche und Erwachsene mehr von Optikusneuritis, einer Sehnerventzündung, betroffen sind. LETM (Transverse Myelitis bzw. Longitudinal Extensive Transverse Myelitis) trifft ebenso eher Jugendliche und Erwachsene und ist hauptsächlich durch Lähmungserscheinungen gekennzeichnet. Bis zur Hälfte aller MOGAD-Patient:innen sind von einem schubhaften Verlauf (multiphasisch) betroffen, während die übrigen an MOGAD Erkrankten eine einmalige, akute Krankheitsphase erleben.
(Innsbruck, am 20.11. 2025, Text: T. Mair, Foto: MUI/M. Baumann)