Von der Fettleber zur Leberentzündung
Im Rahmen einer bereits mehrjährigen Forschungskooperation zwischen der Arbeitsgruppe um Michael Karin vom Labor für Genregulation und Signaltransduktion der University of California San Diego und dem Team um den Entwicklungsimmunologen Andreas Villunger vom Innsbrucker Biozentrum ist es gelungen, einen Schlüsselschritt in der Pathogenese der nicht-alkoholischen Leberentzündung (NASH) zu enthüllen.
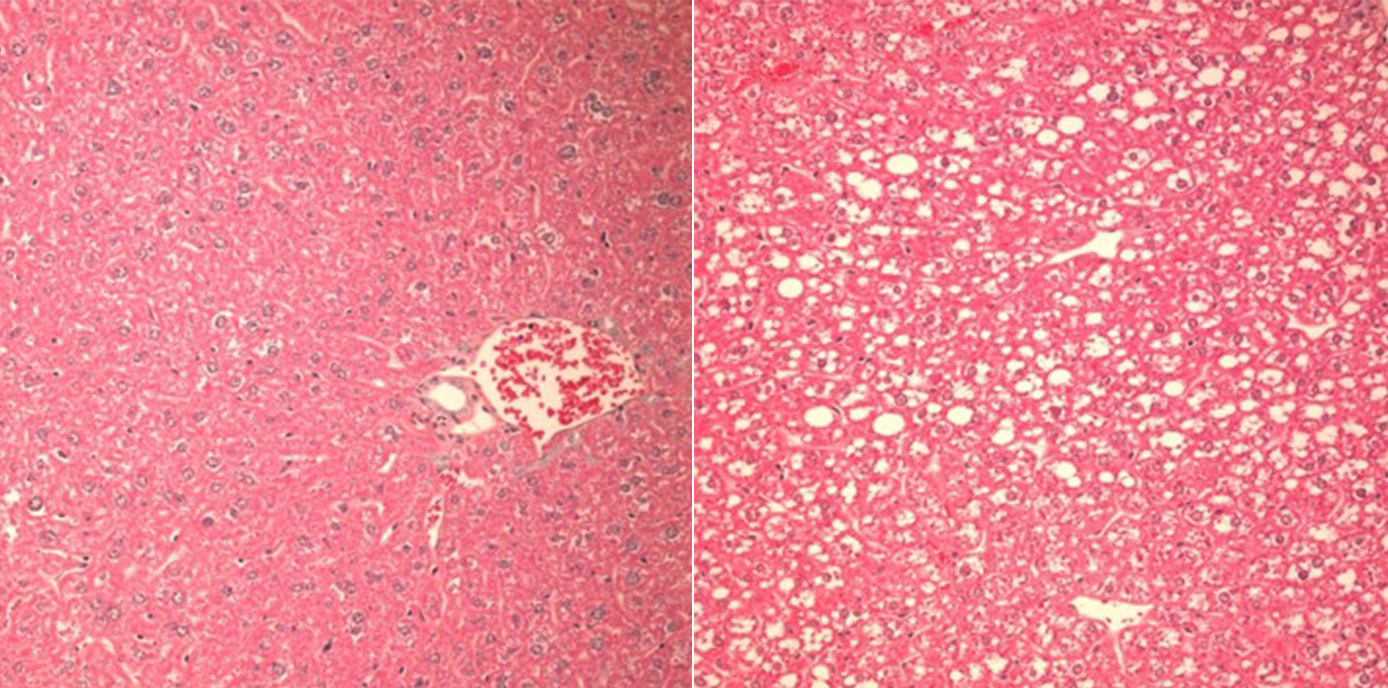
Die nicht-alkoholische Steatohepatitis, kurz NASH, ist eine Leberentzündung, die im Rahmen einer Leberverfettung (Steatosis hepatis, NAFLD) auftritt und nicht durch Alkoholkonsum bedingt ist. Sowohl NAFLD als auch NASH sind häufige, durch Veränderungen des Fettstoffwechsels bedingte Stoffwechselerkrankungen, die das Risiko für Leberschäden, Fibrose, Zirrhose, Krebs und Herz-Kreislauf-Erkrankungen beträchtlich erhöhen. Welche Mechanismen dem Übergang von der einfachen Fettleber zur Fettleberhepatitis zugrunde liegen, ist bislang ungeklärt.
Eine rezente, soeben im anerkannten Fachjournal Cell Metabolism veröffentlichte Forschungsarbeit bringt nun mehr Licht in diesen pathologischen Prozess und schreibt der Protease Caspase-2 eine Schlüsselrolle im Fettstoffwechsel der Leber bzw. im Übergang von der Fettleber zur Hepatitis zu.
Caspase-2 ist neben PIDD1 und RAIDD Bestandteil des PIDDosome-Multiproteinkomplexes, den das Team um Andres Villunger, Direktor des Instituts für Entwicklungsimmunologie, schon seit geraumer Zeit untersucht und der sich bereits als vielversprechendes Target für einen therapeutischen Eingriff bei Fettlebererkrankungen herauskristallisiert. Auch die Aufklärung der Rolle des PIDDosoms im Zellteilungsprozess bzw. seine Kontrollfunktionen bei fehlerhafter Zellteilung, die im Zusammenhang mit der frühen Entwicklung sowie der Regenerationsfähigkeit der Leber stehen (siehe auch Ploidy control in hepatic health and disease. https://doi.org/10.1016/j.jhep.2021.06.030), gehen auf das Konto von Villunger und seinen MitarbeiterInnen, darunter Valentina Sladky. Gemeinsam mit der jungen Tirolerin, die am Institut für Entwicklungsimmunologie ihr PhD-Studium absolvierte und nun erfolgreich als Post-Doc an der John Hopkins University in Baltimore, USA, forscht sowie mit PhD-Student Felix Eichin, der von der Österreichischen Akademie der Wissenschaften (ÖAW) unterstützt wird, war Andreas Villunger auch wesentlich an den neuen Erkenntnissen zur NASH-Pathogenese beteiligt.
Auch wenn man noch wenig über Auslöser und Art der Caspase-2-Aktivierung in der verfettenden Leber weiß, konnten die ForscherInnen nun zeigen, dass der Verlust des PIDDosoms bei Fruktose-reicher Diät vor der Zerstörung von Leberzellen, Entzündung und Gewichtszunahme schützt. „In unseren Mausmodellen gelang es, den Einfluss des PIDDosoms auf den Lipid-Stoffwechsel und die Entwicklung hin zur Leberentzündung klar darzustellen: War Caspase-2 ausgeschaltet, entwickelten Mäuse trotz Fruktose-haltiger und Fettsäure-reicher Diät keine Leberschädigung, da die Enzyme, die sonst zur Leberverfettung führen, nicht aktiviert wurden“, beschreibt Villunger die zentrale Erkenntnis.
Die ForscherInnen belegen damit die Existenz eines bisher unerkannten Regulationssystems, das die Homöostase der Leber und die Integrität des Endoplasmatischen Retikulums stützt und so den Übergang von einer einfachen Steatose zu einer Steatohepatitis steuert, indem es den Fettsäure- und Cholesterinstoffwechsel entsprechend diätetischen Herausforderungen anpasst.
Weitere Untersuchungen zielen darauf ab, die Aktivierungsmechanismen von Caspase-2 in Antwort auf Veränderungen in der Nahrung zu identifizieren. „Unsere Ergebnisse weisen darauf hin, dass die Manipulation von Caspase-2-Aktivität eine vielversprechende Strategie für einen therapeutischen Eingriff bei Fettlebererkrankungen sein könnte“, schließt Villunger.
(29.09.2022, Text: D. Heidegger, Bild: V. Sladky )
Links:
PIDDosome-SCAP crosstalk controls diet dependent transition from simple steatosis to steatohepatitis. Kim et al., 2022, Cell Metabolism 34, 1–13, October 4, 2022
Institut für Entwicklungsimmunologie
myPoint-Archiv:
Neues Therapie-Target für die Leberregeneration