Schützt Eisen vor Atherosklerose?
Der erstmalige Nachweis von direkten Interaktionen zwischen Eisenstoffwechsel und Lipidhaushalt könnte einen neuen therapeutischen Weg zur Senkung des LDL-Cholesterinspiegels ebnen und damit die Prävention kardiovaskulärer Erkrankungen optimieren. Die wegweisenden Erkenntnisse sind das Ergebnis einer langjährigen Zusammenarbeit von Innsbrucker Forschungsteams rund um den Internisten und Eisenexperten Günter Weiss. Das renommierte European Heart Journal berichtet.
Ausgangspunkt dieser Forschungsarbeit war die überraschende Entdeckung, dass TrägerInnen eines mutierten HFE-Gens – Veränderungen dieses Proteins lösen die hereditäre Hämochromatose (genetische Eisenüberladung) aus – einen niedrigen LDL-Cholesterinspiegel haben. „Überraschend deshalb, weil Personen mit der genetischen Eisenspeicherkrankheit, übrigens die häufigste rezessive Erbkrankheit bei Europäern, aufgrund von Eisenablagerungen in den Gefäßen ein erhöhtes Atherosklerose-Risiko zugeschrieben wurde. In der Fachwelt herrschte bislang Uneinigkeit darüber, ob eine Eisenüberladung positive oder negative Effekte auf das kardiovaskuläre Risikoprofil hat“, erklärt der Direktor der Innsbrucker Univ.-Klinik für Innere Medizin II, Günter Weiss, der bereits seit vielen Jahren zum Eisenstoffwechsel und damit assoziierten Erkrankungen forscht.
Regulation von LDL-Rezeptoren und Cholesterin-Transport
Bei einem im Labor von Günter Weiss etablierten Knockout Mausmodell mit Eisenüberladung und einem dem menschlichen Organismus angeglichenen Cholesterin-Spiegel konnte das Team, darunter Egon Demetz und Ivan Tancevski, nach der Verabreichung einer Eisendiät feststellen, dass die Mäuse weniger Atherosklerose entwickelten. Die Innsbrucker ForscherInnen konnten zudem in über 200.000 humanen Proben von HFE-GenträgerInnen aus verschiedenen Biodatenbanken und Genomweiten Assoziationsstudien niedrige LDL-Werte nachweisen. „In unseren Untersuchungen identifizierten wir schließlich drei Mechanismen, die diesen Zusammenhang aufklären. Wir konnten nachweisen, dass das Hämochromatoseprotein HFE die Expression des LDL Rezeptors auf Leberzellen reguliert, indem es sie an der Zellmembran verfügbar macht und dass auch Kupffer Zellen, das sind die Fresszellen der Leber, LDL-Rezeptoren exprimieren und so an der Verstoffwechslung des LDL-Cholesterins beteiligt sind“, so Tancevski. „Für den Transfer von den Blutfetten aus diesen Kupffer Zellen ist schließlich das Eisen zuständig, indem es das Transportprotein ABCA1 hochreguliert, sodass LDL aus dem Serum abtransportiert wird“, ergänzt Egon Demetz, Erstautor der Arbeit, die physiologischen Details.
 1
1 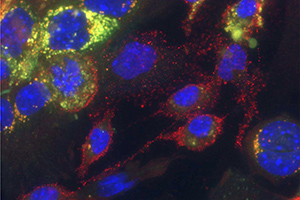 2
2
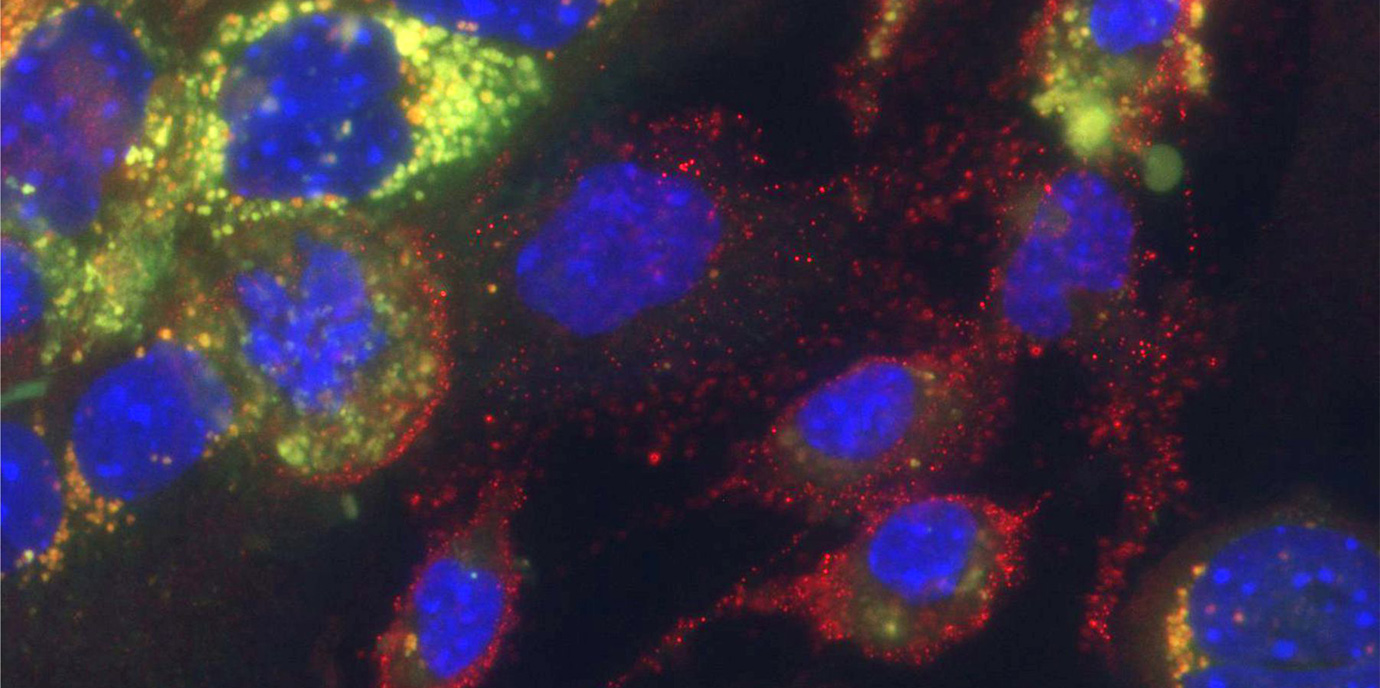
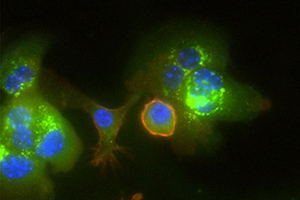
BU Abb. 1: Mikroskopische Aufnahme von Kupfferzellen (rot umrandet) und primären Hepatozyten. Das LDL-Cholesterin ist grün gefärbt. Zu diesem Zeitpunkt (24h nach Eisendiät) sind die meisten Kupfferzellen noch grün markiert, sie transferieren ihre Ladung (Cholesterin) zu den Hepatozyten. (Zellkerne sind blau gefärbt).
BU Abb. 2: Mikroskopische Aufnahme von Kupfferzellen (rot umrandet) und primären Hepatozyten nach 48h. Das Cholesterin (grün) wurde fast vollständig an die primären Hepatozyten abgegeben.
Neuer Ansatz zur Behandlung der Hypercholesterinämie
Die Aufklärung dieses Zusammenhangs wollen die Innsbrucker ForscherInnen nun für neue Strategien zur therapeutischen Vorbeugung von Atherosklerose nützen. „Vor allem im Rahmen der familiären Hypercholesterinämie, bei der ein genetischer Defekt die Funktion des LDL-Rezeptors beschränkt, ist es denkbar, diese Interaktion zwischen dem HFE-Protein, den Kupffer Zellen und Eisen zu forcieren, um mehr LDL aus dem Serum zu transportieren und den Cholesterinspiegel zu senken“, so Weiss.
Die im European Heart Journal veröffentlichten Erkenntnisse basieren auf der langjährigen und erfolgreichen Zusammenarbeit zahlreicher Arbeitsgruppen und Institute am Standort, darunter die Univ.-Klinik für Neurologie (Direktor: Stefan Kiechl) und das Institut für Genetische Epidemiologie (Direktor: Florian Kronenberg) im Rahmen des Global Lipids Genetics Consortiums (GLGC).
(21.04.2020, Text: Doris Heidegger, Fotos: MUI/ Innere II)
Links:
The haemochromatosis gene Hfe and Kupffer cells control LDL cholesterol homeostasis and impact on atherosclerosis development. Egon Demetz et al, Eur Heart J. 2020 Mar 30. pii: ehaa140. [Epub ahead of print]
Univ.-Klinik für Innere Medizin II