Zelluläre Müllentsorgung: Innsbrucker Zellbiologen entdecken neuen Protein-Abbau-Weg mit unerwarteter Funktion
Damit Zellen ihre Funktion erfüllen und gesund bleiben, müssen laufend neue Proteine gebildet sowie alte und fehlerhafte Proteine entfernt werden. Ein Team um den Zellbiologen David Teis vom Biozentrum der Medizin Uni Innsbruck konnte nun einen neuen Protein-Abbau-Weg identifizieren, der zudem auch eine essentielle Funktion im intrazellulären Lipidstoffwechsel erfüllt. Das neue Wissen lässt potentielle Therapie-Ansätze für den gezielten Abbau von Proteinen erwarten.
Zellen müssen ihren intrazellulären Abfall entsorgen und recyclen. Damit wird verhindert, dass sich Proteine ansammeln und Schaden anrichten. Zellen bedienen sich dafür eines ausgeklügelten Müll-Managements, das bestimmte Gruppen von Proteinen in unterschiedliche Proteinabbau Systeme einschleust. Für den gezielten Abbau von Membran-Proteinen waren bisher zwei Entsorgungswege bekannt: ERAD (ER-assoziierte Proteindegradation) und der ‚multivesicular body‘ (MVB) Weg, der vom Proteinkomplex ESCRT (‚endosomal sorting complexes required for transport’) gesteuert wird. „Sind diese Abbauprozesse aufgrund einer Fehlfunktion gestört, kann das zu schwerwiegenden Erkrankungen von Krebs bis Neurodegeneration führen“, weiß Zellbiologe David Teis, der mit seinem Team an der Sektion für Zellbiologie (Leiter: Lukas Huber) des Innsbrucker Biozentrum seit vielen Jahren zum Zellstoffwechsel forscht und die Funktion des ESCRT-Komplexes bereits maßgeblich aufklären konnte.
Regieübernahme bei der zellulären Müllentsorgung
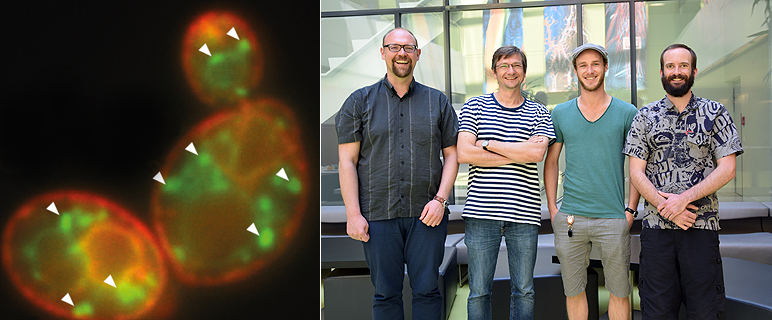
Erstautor Oliver Schmidt aus dem Innsbrucker Biozentrum stellte sich nun die Frage, ob tatsächlich alle Protein-Abbauwege in Zellen bekannt sind oder nicht. Mit Bäckerhefe, einem Modellorganismus, in dem diese hoch konservierten Abbau-Wege ebenso zu finden sind wie in humanen Zellen, entdeckte das Team tatsächlich einen neuen Abbau-Weg. „Durch die Ausschaltung des ESCRT-Systems konnten wir mit genetischen Screens erkennen, dass ein weiterer Mechanismus – EGAD (Endosome und Golgi-assozierte Degradation) – eine zentrale Rolle im Müllmanagement übernimmt“, so Schmidt. Der EGAD-Prozess benutzt eine molekulare Maschine, die unter anderem Membran-Proteine aufspürt, die verwaist sind und nicht auf den richtigen Organellen sitzen. Sind diese verwaisten Proteine einmal erkannt, sorgt EGAD dafür, dass sie für den Abbau markiert und aus der Membran der Organellen herausgelöst werden. Erst in dieser Form können sie vom Proteasom, einem zellulären Müllzerkleinerer, abgebaut werden.
Überraschende Rolle im zellulären Lipidstoffwechsel
Unter den Proteinen, die über den EGAD-Pfad abgebaut werden, fanden sich auch viele, die im Fettstoffwechsel der Zelle eine Rolle spielen. „Unsere Experimente zeigen, dass zu wenig Sphingolipide produziert werden, wenn der EGAD-Weg nicht funktioniert“, erklärt Teis. Sphingolipide sind spezielle Fettmoleküle und einer der Hauptbestandteile in der Membran tierischer Zellen. Ein Mangel an Sphingolipiden führt zu einer falschen Zusammensetzung der Membranen und damit zu schweren Membran-Defekten. Die Zellen regeln die Produktion von Sphingolipiden über die Orm-Proteine. „Orm2, ein Substrat des EGAD-Wegs, das wir im Hefe-Modell gefunden haben, kommt auch in humanen Zellen vor und wird mit der Entstehung chronisch entzündlicher Erkrankungen wie Morbus Crohn oder Asthma in Verbindung gebracht“, so Schmidt, der für sein Proteinabbau-Forschungsprojekt bereits mit einem "LEA-Lipidomics excellence award" ausgezeichnet wurde. Der von der Firma Lipotype neu ins Leben gerufene Forschungspreis wird von einer internationalen Fachjury vergeben. Oliver Schmidt will sich in weiteren Untersuchungen auf den Einfluss des EGAD-Pfades im Rahmen des Fettstoffwechsels fokussieren.
Der EGAD-Pfad könnte sich als vielversprechende Angriffsfläche für neue therapeutische Ansätze erweisen. „Unsere Ergebnisse dürften für künftige biotechnologische Innovationen, also für die Entwicklung von Medikamenten relevant sein, mit denen Proteine gezielt abgebaut werden sollen. Damit könnte es gelingen, die schädliche Akkumulation von Proteinen zu korrigieren und die Behandlung von damit verbunden Erkrankungen zu ermöglichen“, schließt Teis.
Die rezenten FWF-unterstützten Forschungsarbeiten des Teams um David Teis mit Erstautor Oliver Schmidt, dem MCBO-Doktoranden Yannick Weyer und dem Molekulare-Medizin Master-Studenten Michael Widerin, entstanden in Zusammenarbeit mit weiteren Arbeitsgruppen des Biozentrums, insbesondere unter Mithilfe der Protein Core Facilty unter Herbert Lindner und Leopold Kremser, sowie mit einem internationalen Team von Wissenschafter*innen der ETH Zürich, der Universität Osnabrück und dem Research Institute of Molecular Pathology, IMP, in Wien und wurden in der renommierten Fachzeitschrift The EMBO Journal publiziert.
(D. Heidegger)
Links:
Endosome and Golgi‐associated degradation (EGAD) of membrane proteins regulates sphingolipid metabolism. Oliver Schmidt et al. The EMBO Journal (2019) e101433
https://doi.org/10.15252/embj.2018101433
Lipidomics Excellence Award 2019
https://www.lipotype.com/lipidomics-excellence-award/
AG David Teis
https://www.i-med.ac.at/cellbio/labore/Membrane_Traffic_and_Signaling/index.html
Sektion für Zellbiologie
https://www.i-med.ac.at/cellbio/
myPoint-Archiv: Wie Zellen ihren Sondermüll entsorgen
https://www.i-med.ac.at/mypoint/news/682025.html