Research
Research Profile
In order to understand the physiology and pathophysiology of T-lymphocyte biology, it is necessary to decode the biochemical processes that integrate key signals received from antigen, cytokine and integrin-receptors as well as inhibitory receptors. The underlying goal of our work is to understand the selective functions of defined signal transduction pathways in CD4+ and CD8+ T-lymphocytes and to use this information to develop strategies for manipulating the immune response, either in order to promote immunosuppression in the context of autoimmune diseases and graft rejection or for augmentation as part of an innovative cancer immunotherapy-based approach.
In the exploration of distinct members of the AGC family of protein serine/threonine kinases and their effector substrates, our recent data strongly suggest that T cell-based immunotherapies could benefit greatly from the modulation of key signalling pathways that govern T cell dysfunctions, i.e. in cancer-mediated immune evasion. Remarkably, the strategy of intracellular NR2F6 and/or Cbl-b checkpoint-targeting therefore appears to be particularly capable of improving efficacy and broadening the applicability of cancer immunotherapy regimes and it consequently has the potential to lead to prolonged patient survival in the future.
The cell genetics team has expertise in mouse genetics and in signal transduction analyses of effector/memory T cell differentiation and the ability of these cells to alter adaptive immune response outcomes. In particular, we have acquired experience in the investigation of molecular signalling processes through the use of hypothesis-driven mechanistic studies and by using unbiased CRISPR/Cas9-based genetics screens and RNA sequencing to characterise key protein-protein and protein-DNA interactions.
Our late-braking research topic:
Mechanistic Understanding of T-Cell Persistence in Host-Protective Tumour Immunity
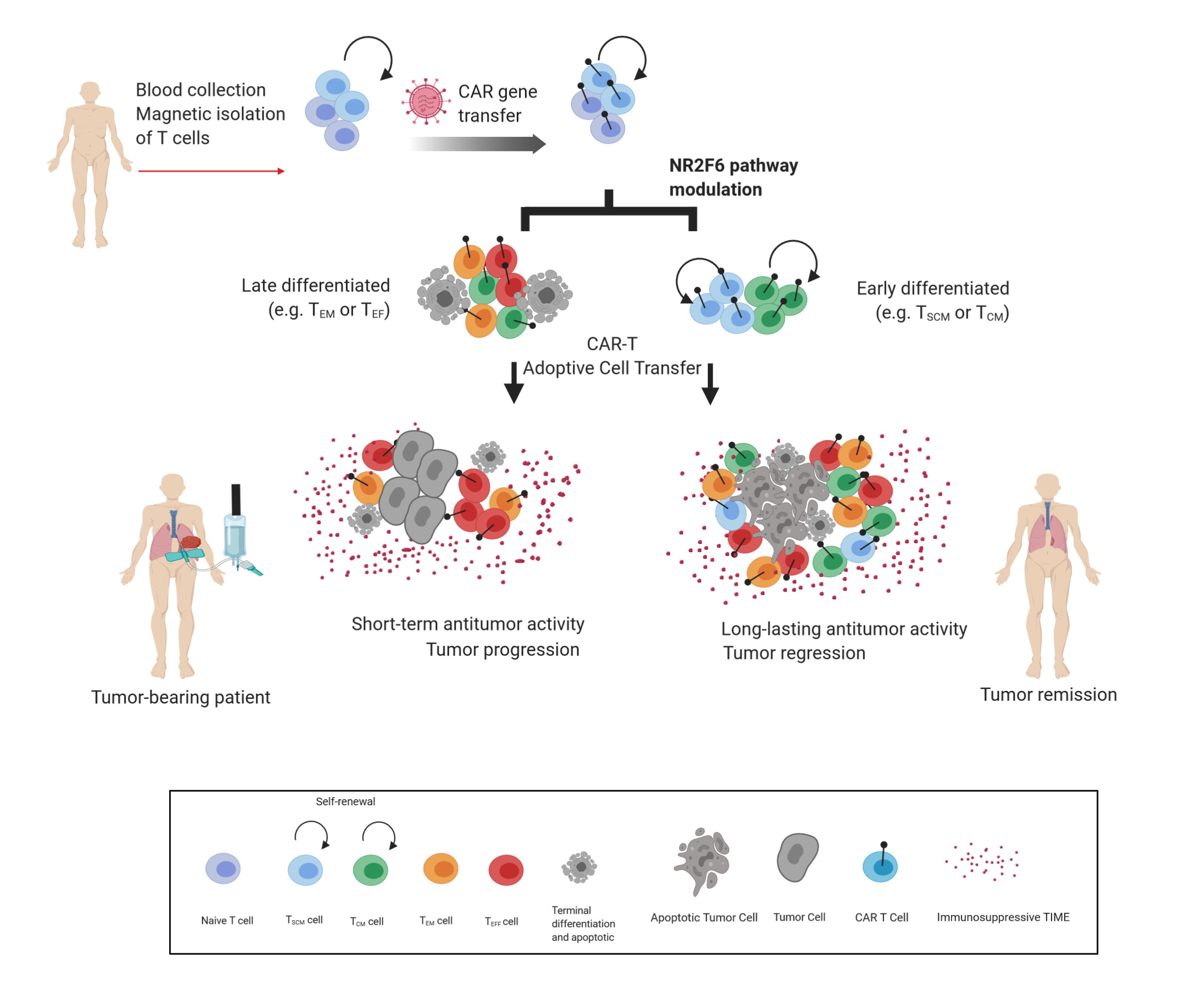
The Cell Genetics team was the first to reveal the T-lymphocyte-intrinsic PKCtheta/NR2F6/Cbl-b axis as an essential signalling node governing the complex host-tumour interactions at the intersection between inflammation and cancer. Modulation of this signalling pathway renders effector T cells capable of rejecting otherwise lethal tumour burdens and their metastases in preclinical cancer model systems. Our research aims to elucidate the inter and intra-cellular mechanisms that reshape the immune contexture to allow superior tumour rejection (Fig. 1).
Fig. 1: Leverage of CD8+ T cell persistence to extend Chimeric Antigen T cell -engineered (CAR-T) therapy to solid cancer.
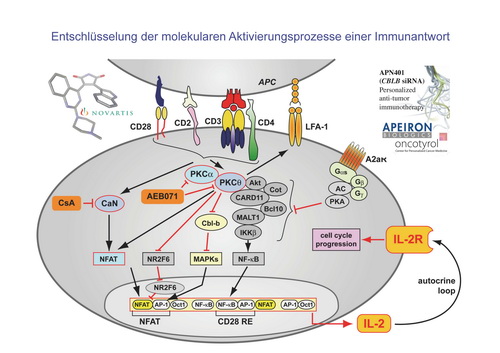
Entschlüsselung molekularen Aktivierungsprozesse einer adaptiven Immunantwort
Gottfried Baier & Team
Viele klinisch relevante Fragestellungen und Probleme beruhen auf Prozessen, die vom Immunsystem eingeleitet und unterhalten werden (z.B. Autoimmunität, Organtransplantation, Tumorimmunologie, Infektionsimmunologie). Um die Physiologie und Pathophysiologie des Immunsystems verstehen zu können, ist es unabdingbar, die molekularen Mechanismen, die einer Immunantwort zu Grunde liegen, aufzuklären. Die Entschlüsselung dieser zellulären Aktivierungsprozesse ist nicht nur für das Verständnis der Physiologie des Immunsystems von Bedeutung, sondern sie liefert auch den Schlüssel, Störungen des Immunsystems zu verstehen und, was noch wichtiger erscheint, in der Zukunft besser therapieren zu können. Die Arbeitsgruppe von Gottfried Baier and der Medizinischen Universität Innsbruck befasst sich mit der Aufklärung der molekularen Mechanismen des signalübertragenden Netzwerks in T-Lymphozyten. Hierzu werden moderne biochemische, molekularbiologische und gentechnische Zugänge gewählt, unter anderem die Generierung von Knockout- und transgenen Mäusen.
Die Forschergruppe von Univ.Prof. Dr. Gottfried Baier ist im Bereich der Molekularen Immunologie tätig und leistet seit Jahrzehnten einen Beitrag zur Entschlüsselung der molekularen Aktivierungsprozesse einer erworbenen Immunantwort. Das Forschungsthema ist, wie in Abb. 1 schematisch dargestellt, das faszinierend-komplexe signalübertragende Netzwerk einer Immunzelle, das aus Liganden Rezeptoren, Proteinkinasen, Effektorproteine sowie Transkriptionsfaktoren besteht, und präzise und punktgenau wie ein Uhrwerk eine angemessene Immunantwort ermöglicht.
Da diese Aktivierungsprozesse der Immunzelle die Einleitung, Unterhaltung und Beendigung einer Immunantwort bedingen, haben diese Arbeiten im Laufe der Jahre eine stark angewandte Forschungsorientierung bekommen. Zum einen war es dem Team um Prof. Baier möglich -als akademischer Begleiter- bei der Entwicklung des neuen immunosuppressiven Medikaments SOTRASTAURIN von Novartis Basel dabei zu sein; diese Substanz befindet sich dzt. in der klinischen Prüfung für die Indikationen Transplantationsmedizin und Autoimmunität. Zum anderen hat das Team von Prof. Baier im Rahmen von ONCOTYROL einen völlig neuartigen Krebs-Immuntherapieansatz entwickelt & präklinisch (d.h. im Mausmodell) etabliert, der Immunzellen aktiver in der Bekämpfung von Tumorzellen machen kann. Dieses Konzept befindet sich dank des österreichischen Wirtschaftspartner Apeiron Biologics in Wien ebenfalls auf dem Niveau einer klinischen Testung.
Es bestehen aber auch eine Vielzahl rein akademischer Fragen zum Ziele des Verständnisses der „Molekularen Anatomie einer Immunzellantwort“, die im internationalen Verbund mit führenden Immunologie Konsortia von Prof. Baier bearbeitet werden.



